De lever speelt een belangrijke rol bij veel metabole processen in het lichaam, waardoor de klinische verschijnselen bij primaire of secundaire aantasting van de lever zeer divers kunnen zijn. Wanneer bloedonderzoek aanwijzingen geeft voor een leveraandoening, kan door middel van aanvullend onderzoek de oorzaak in veel gevallen worden achterhaald. Met behulp van echografie kan de lever worden beoordeeld en inzicht worden verkregen in de aard van de aandoening. Voor veel leveraandoeningen is echter aanvullend pathologisch onderzoek nodig om tot een definitieve diagnose te komen. Daarom in deze nieuwsbrief een interessante casus over de lever en de nodige achtergrondinformatie over cytologische en histologische leverbiopten.
Direct naar:
Casus Beau-Guy

Beau-Guy, een 11,5 jaar oude kruising Yorkshire Terrier, wordt naar ons doorgestuurd in verband met een massa bij de anus. De massa is 1,5 x 1,5 x 3 centimeter groot en heeft heftig gebloed. Beau-Guy vertoont verder klinisch geen klachten, de ontlasting is normaal en ook aan de vorm is niets te zien.
Klinische bevindingen
Bij het algemeen lichamelijk onderzoek valt de opvallend forse buikomvang op. Verder worden bij het algemeen lichamelijk onderzoek geen bijzonderheden gevonden. De massa zit op elf uur ten opzichte van de anus, dat maakt een tumor vanuit de anaalzak minder waarschijnlijk. In klinisch opzicht wordt gedacht aan een perianaalklieradenoom.
Aanvullend onderzoek
Bloedonderzoek laat sterk verhoogde AF- en GPT-waardes zien. Op grond van de zeer bolle buik en de gevonden afwijkingen in het bloed is besloten om echografisch onderzoek te doen van het abdomen. Hierbij wordt een fors onregelmatig proces in de lever gezien. Verder zijn in het abdomen geen vergrote lymfeknopen of andere afwijkingen waarneembaar. Onder echobegeleiding worden vervolgens aspiratiebiopten van de lever genomen. Uiteraard zijn ook van de massa naast de anus, waarvoor Beau-Guy doorgestuurd was, dunne naald aspiratiebiopten (DNAB’s) genomen. Voor een volledige stagering worden er ook thoraxfoto’s gemaakt. Hierop zijn geen afwijkingen zichtbaar.
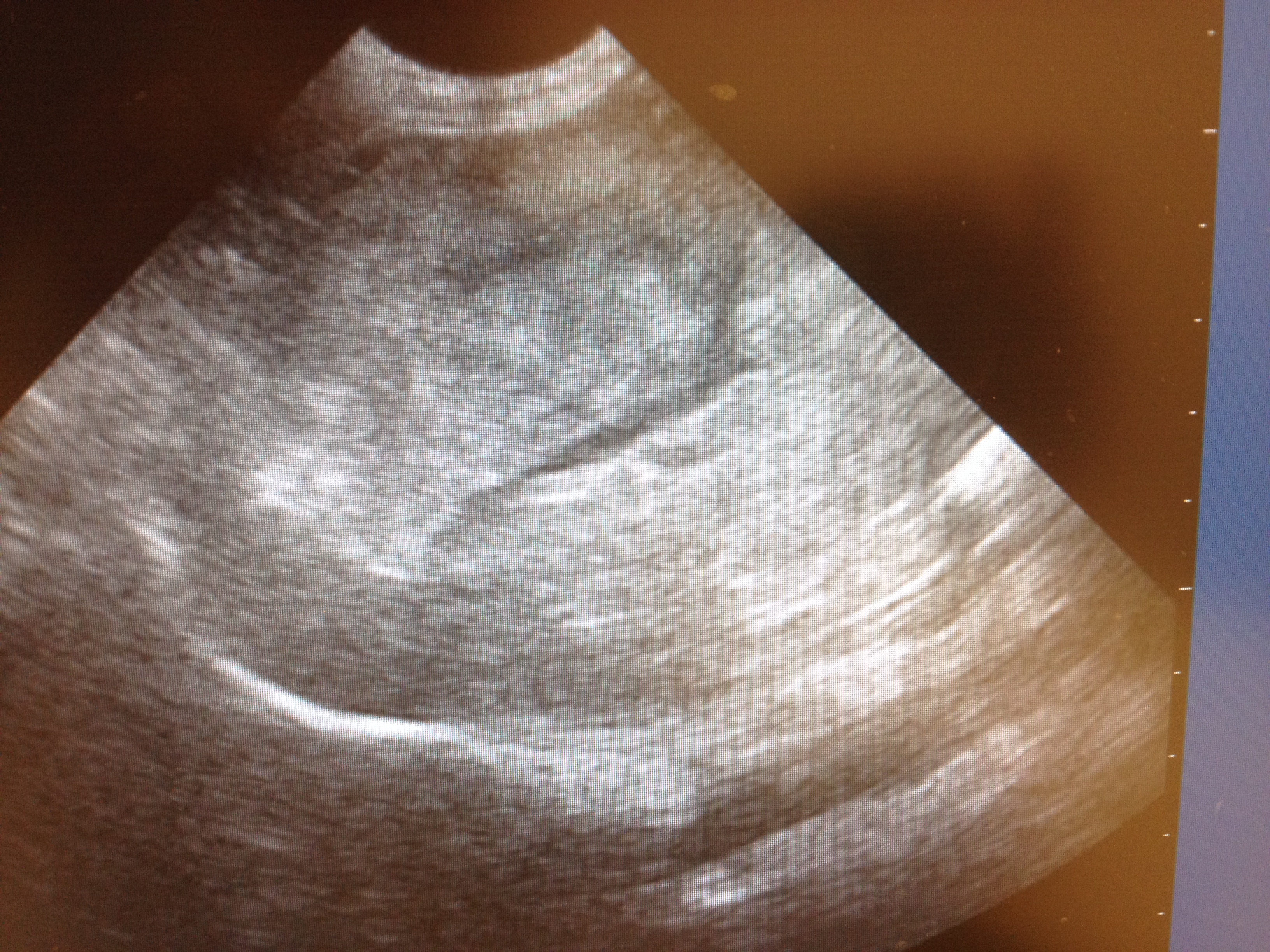 Echografisch onderzoek bij Beau-Guy toont het bovenstaande beeld
Echografisch onderzoek bij Beau-Guy toont het bovenstaande beeld
Uitslagen aanvullend onderzoek
DNAB van het proces naast de anus: zeer veel debris en cellulair aspect van epitheliale tumor met maligne celkenmerken. Hierbij dient aangemerkt te worden dat necrose/ontsteking vaak resulteert in hyperplasie/activatie van omliggende cellen die daardoor morfologisch immature kenmerken vertonen.
DNAB van de lever: cellulair aspect van een epitheliale proliferatie/neoplasie met geringe focale necrose.
Behandeling
Aangezien de massa bij de anus geregeld heftig bloedde wordt besloten deze massa chirurgisch te verwijderen, ondanks de aanwezigheid van de uitgebreide laesie in de lever.
Tijdens de operatie blijkt het proces niet vergroeid te zijn met de anale sfincter en kan ook de afvoergang van de anaalzak gespaard worden. Hierdoor kan het proces volledig verwijderd worden. Ook worden onder echobegeleiding Tru-Cut biopten van de lever genomen.
Uitslagen pathologie
De histopathologie van de verwijderde massa geeft aan dat het hier gaat om een goed gedifferentieerd perianaalklierweefsel, omgeven door gecomprimeerd collageen, maar met lokaal geringe ingroei in stromale component. Dat is indicatief voor expansieve groei en dus voor het neoplastische karakter van de leasie. Er is sprake van ulceratie en in oppervlakkig gelegen lobuli multifocale centrale necrose van het neoplastisch weefsel. Conclusie: aspect perianaalklieradenoom waarbij -gelet op focale stromale ingroei en multifocale necrose- enige maligniteit niet kan worden uitgesloten. De tumor lijkt macroscopisch en microscopisch geheel verwijderd. De Tru-Cut biopten van de lever geven het beeld van een goed gedifferentieerde hepatocellulaire tumor.
Aanvullingen pathologie
Van beide anatomische locaties bij de hond is bekend dat behalve neoplasiën ook niet-neoplastische weefsel proliferaties voorkomen, namelijk respectievelijk perianaalklierhyperplasie en nodulaire hyperplasie van leverweefsel. Hyperplastisch weefsel en benigne neoplastisch weefsel vertonen sterke morfologische overeenkomsten, wat de differentiatie bemoeilijkt. Van levercellen is bekend dat met leeftijdstoename de morfologische kenmerken veranderen en wel dusdanig dat deze die van neoplastische cellen benaderen. Van beide locaties is bovendien ook bekend dat benigne tumoren en goed gedifferentieerde carcinomen zodanig morfologisch op elkaar kunnen lijken dat zelfs histologische differentiatie soms nauwelijks of niet goed mogelijk is. Zo kan een goed gedifferentieerd hepatocellulair carcinoom zich uitsluitend van prae-existent leverweefsel onderscheiden door het ontbreken van portale gebieden in het neoplastisch leverweefsel. In perianaalklieradenomen kunnen focaal gedeelten voorkomen met pleomorfie passend bij maligne transformatie. Zoals gebruikelijk geldt zeker bij deze anatomische locaties dus dat uitslagen van het aanvullend onderzoek nadrukkelijk in samenhang met andere data van de patiënt geïnterpreteerd dienen te worden.
Nabehandeling
Het perianaalklieradenoom is volledig verwijderd en behoeft daarmee geen aanvullende behandeling.
Voor de behandeling van hepatocellulaire tumoren geniet chirurgische verwijdering (lobectomie) de voorkeur. In de literatuur wordt een mediane overlevingstijd van meer dan vier jaar aangegeven na lobectomie, terwijl honden met een conservatieve behandeling slechts negen maanden wordt gegeven. De prognose voor gelocaliseerde hepatocellulaire carcinomen na chirurgie is dus in verhouding goed, met een kans op recidive van de tumor van slechts 10 procent. In ongeveer 35 procent van de gevallen zal metastasering naar andere gebieden in de lever of naar de longen optreden. Bij nodulaire en diffuse vormen van hepatocellulaire carcinomen is de prognose daarentegen zeer ongunstig omdat chirurgische verwijdering niet mogelijk is.
Gezien de leeftijd van Beau-Guy en de omvang van de operatie ziet de eigenaresse af van chirurgie en besluit tot palliatieve behandeling. In de literatuur wordt beschreven dat met name in goed gedifferentieerde hepatocellulaire carcinomen COX2 expressie hoog is. Daarom wordt gekozen voor een behandeling met een NSAID (Metacam®).
Vervolg
De negentien maanden daarna gaat het zeer goed met Beau-Guy. Regelmatige controles met behulp van echografisch onderzoek tonen aan dat er sprake is van een ‘stable disease’.
Van de een op de andere dag stort de hond echter volledig in. Uit de anamneses komt naar voren dat Beau-Guy de dagen ervoor zeer donkere tot zwarte ontlasting heeft gehad en dat hij ook bruin/bloederig gebraakt heeft. Bloedonderzoek toont een ernstige anemie aan met een Ht van 0,16l/l. Echografisch onderzoek bevestigt het vermoeden van een maagulcer.
Behandeling
Gezien het mogelijke verband met het geven van NSAIDs wordt gestopt met de metacam en start de behandeling van het maagulcer met ulcogant, maagzuurremmers en anti-emetica. Aangezien Beau-Guy klinisch stabiel is, krijgt hij op dat moment nog geen bloedtransfusie, maar wordt besloten hem zeer regelmatig te monitoren. Hij knapt snel op: na een week is de Ht gestegen tot 0,22l/l. In de volgende weken wordt Beau-Guy weer helemaal de oude en stijgt de Ht verder tot 0,37l/l.
Voor veel primaire hepatobiliaire ziekten bij de hond en kat is een leverbiopsie nodig om een diagnose en prognose te kunnen stellen. In de volgende gevallen is biopsie aan te raden:
- Afwijkende leverwaarden, met name als deze langer dan een maand aanwezig zijn.
- Hepatomegalie door onbekende oorzaak
- Voor het vaststellen van leveraantasting bij systemische ziekte
- Stagering neoplastische aandoeningen
- Objectieve beoordeling van respons op therapie
- Progressie beoordelen van een eerder gediagnostiseerde, niet behandelbare aandoening
Voor bioptname dient het dier twaalf uur te vasten en moet onderzoek op de coagulatiestatus van de patiënt plaatsvinden. Milde afwijkingen in de coagulatiestatus sluiten een leverbiopsie niet uit. Bij klinische aanwijzingen voor verhoogde bloedingsneiging of bij een sterk afwijkende coagulatietest is het beter de leverbiopsie uit te stellen. Contra-indicaties voor leverbiopsie zijn een afwijkende hemostase, veroorzaakt door thrombocytopenie (thrombocyten <30.000/µl) of verlaagde coagulase-activiteit, en verdenking op een hemangiosarcoom dat kan ruptureren . Wanneer er tijdens of na de biopsie een oncontroleerbare bloeding optreedt, dan is een bloedtransfusie met volbloed of plasma geïndiceerd.
Als de verwachting is dat chirurgische behandeling van een leveraandoening mogelijk is, dan is een percutaan leverbiopt niet raadzaam. In dergelijke gevallen geniet het nemen van een chirurgisch biopt tijdens de operatie de voorkeur.
Er zijn verschillende methoden beschikbaar om een leverbiopt te nemen. De keuze is afhankelijk van verschillende factoren, zoals de kenmerken van de hepatobilaire aandoening, de klinische status en geschiktheid voor anesthesie en de coagulatiestatus. Ook zaken als beschikbare apparatuur, ervaring met de gekozen biopsietechniek en kans op complicaties spelen hierbij een rol. Percutane biopsie technieken zijn bruikbaar bij honden en katten met hepatomegalie en echografische aanwijzingen voor diffuse, uniforme parenchymale leveraandoeningen.
Dunne naald aspiratie biopten
In eerste instantie kan vaak een dunne naald (aspiratie) biopt genomen worden, omdat de diagnose die daaruit voortvloeit aanwijzingen kan geven voor bepaalde aandoeningen, zoals vacuolaire hepatopathie (lipidose, steroid hepatopathie) en rondceltumoren.
Daarnaast kunnen metastasen in de lever met echografie een soortgelijk beeld opleveren als benigne hyperplasie of regeneratieve noduli. Bij de aanwezigheid van meerdere noduli is het dan ook raadzaam om dunne naald (aspiratie) biopten (onder echobegeleiding) te nemen.
Voor het nemen van een dunne naald (aspiratie) biopt, kan een standaard oranje (25G) naald gebruikt worden. Als dieper gelegen laesies hiermee niet bereikbaar zijn , is het gebruik van de mandarijnnaald van een blauwe vene braunule (22G) een goede en praktische oplossing.
Voordeel van deze techniek is dat het niet nodig is om vooraf de coagulatiestatus van de patiënt te controleren. Daarnaast is het een snelle, non-invasieve methode die doorgaans zonder sedatie of anesthesie uitvoerbaar is. Het is wel belangrijk om te realiseren dat een groot aantal primaire en secundaire leveraandoeningen vaker gepaard gaan met architectuurveranderingen in de lever dan met celveranderingen van de hepatocyten. Op basis van deze architecturale veranderingen in de lever is met histopathologisch onderzoek een specifieke diagnose vaak juist wel mogelijk. Dat is niet het geval met cytologisch onderzoek omdat zulke veranderingen niet door middel van cytologisch onderzoek kunnen worden gedetecteerd.
‘Dikke’ naald biopten'
Voorafgaand aan de biopsie moet duidelijk zijn dat er een grote kans is op het verkrijgen van een diagnostisch monster zonder complicaties. Aangezien er maar een kleine incisie nodig is voor de bioptname, is de wondgenezing geen probleem, ook niet bij dieren met hypoalbuminemie. De procedure is vaak snel en vereist alleen diepe sedatie.
Bij gegeneraliseerde hepatomegalie kan het biopt eventueel ‘blind’ genomen worden, maar bioptname onder echobegeleiding geniet de voorkeur. Als de apparatuur hiervoor niet beschikbaar is, verdient het waarschijnlijk de voorkeur om blind een dunne naald aspiratie biopt te nemen.
Wanneer men kiest voor een dikke naaldbiopt, dan dient de grootst mogelijke naald gekozen te worden (liefst 14G, minimaal 16G) om adequate biopten voor onderzoek te garanderen. De meest gebruikte bioptnaalden zijn de Tru-cut- en Menghini naalden.

Tru-Cut naald

Menghini naald
Bij een gegeneraliseerde hepatomegalie met diffuse veranderingen op het echobeeld is elk gebied in de lever representatief voor de aandoening. De galblaas mag echter niet worden aangeprikt. Het dier wordt meestal in rechter zijligging geplaatst en de linker leverlob wordt aangeprikt. Door het hoofd en thorax iets hoger te plaatsen, wordt de lever makkelijker bereikbaar. Twee of drie complete core-biopten worden genomen. Indien nodig kan één biopt in een steriele container geplaatst worden voor bacteriologisch onderzoek. Elk biopt kan op een stevig papier geplaatst worden om de oriëntatie te behouden voordat het in formaline gaat voor histologisch onderzoek.
Na de bioptname wordt een klein verband aangebracht om de wond schoon te houden en wordt het dier op de andere zijde geplaatst zodat het lichaamsgewicht de regio van de bioptname in de lever dichtdrukt.
Met behulp van echografie of een gemodificeerde laparoscopische techniek kan een gevisualiseerd percutaan naaldbiopt genomen worden. Hiermee kan het gebied voor bioptname zorgvuldig gekozen worden en is inspectie na de biopsie mogelijk. Daarnaast is aspiratie van de galblaas mogelijk voor voor cytologisch en/of bacteriologisch onderzoek. Om lekkage van gal te voorkomen, moet de gehele galblaas leeggemaakt zijn.
Grote hoeveelheden abdominale vloeistof kunnen het zicht tijdens laparoscopie op de lever en omliggende structuren hinderen. Dit dient dan ook voorafgaand aan een laparoscopische bioptname verwijderd te worden.
Chirurgische bioptname
Vooral bij een kleine en/of stevige fibrotische lever is het lastig om biopten te verkrijgen via percutane biopsie. Dat resulteert vaak in kleine, gefragmenteerde biopten die lastig te onderzoeken zijn. Een chirurgische bioptname (laparoscopie of laparotomie) is dan ook raadzaam als de lever erg klein is, als er geen echografie beschikbaar is, als de practicus niet bekend is met de genoemde percutane naald technieken of als een eerder naaldbiopt geen diagnostische uitslag heeft gegeven.
Tijdens laparotomie is grondig onderzoek mogelijk van de lever, galwegen, portaalvaten en andere structuren zoals lymfeknopen. De procedure is meer invasief en er kunnen complicaties met de wondgenezing optreden bij dieren met hypoalbuminemie. Een voordeel is dat deze methode grotere biopten kunnen opleveren voor histopathologisch onderzoek en dat bloedingen direct te controleren zijn. Van de leverbiopten kunnen afdrukpreparaten voor cytologisch onderzoek worden gemaakt voordat deze in de formaline gaan. Dit kan door het biopt eerst op een gaasje te stempelen om overmatig bloed te verwijderen, waarna voorzichtig afdrukken gemaakt worden op een voorwerpglaasje.
Voor routine histopathologisch onderzoek van de leverbiopten dienen deze in 10% gebufferd formaline geplaatst te worden. Om beschadigingen van de kwetsbare Tru-Cutbiopten tijdens het transport naar het pathologie laboratorium te voorkomen, dient men het potje volledig met formaline af te vullen, zodat geen lucht of zelfs een luchtbel meer aanwezig is. Op deze manier wordt het klotsen van de vloeistof tijdens transport voorkomen, zodat geen fragmentatie van de met veel zorg verkregen biopten optreedt.
Literatuur
Bunch SE, Polak DM, Hornbuckle WE (1985). A modified laparoscopic approach for liver biopsy in dogs. Journal of the American Veterinary Medical Association, 187(10), 1032-1035.
Nelson RW, Couto CG (2003). Small Animal Internal Medicine (3rd ed). Missouri; Mosby.
Roth L (2001). Comparison of Liver Cytology and Biopsy Diagnoses in Dogs and Cats: 56 Cases Veterinary Clinical Pathology. Veterinary Clinical Pathology, 30(1), 35–38.
Withrow SJ, Vail DM (2007). Withrow & MacEwen’s Small Animal Clinical Oncology (4th ed). Missouri; Saunders Elsevier.
Terug naar het begin van dit artikel