- Bluetongue
Bluetongue (blauwtong)
Bluetongue (blauwtong) is een niet-infectieuze virusziekte. De ziekte wordt veroorzaakt door een Orbivirus, dat hoofdzakelijk de binnenzijde van kleine bloedvaten aantast, waardoor oedeem, bloedingen en ulcera kunnen ontstaan. Dieren kunnen elkaar niet onderling besmetten, het virus wordt overgebracht door stekende insecten van het type Culicoides (“knutten”).
Bluetongue is een meldingsplichtige ziekte volgens uitvoeringsverordening (EU) 2018 /1882 van Animal Health Regulation (AHR) (EU) 2016 /429. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA.
Voor meer informatie over de regelgevingen melden kijk op: nvwa.nl/onderwerpen/dierziekten/melden-dierziekte
Voor actuele informatie verwijzen we naar ons Dossier blauwtong. Op de dossierpagina vind je ook de veelgestelde vragen, het behandelplan van GD en altijd de meest actuele nieuwsberichten.
Veterinair kennisdossier Bluetongue
- Verschijnselen
- Diagnose
- Prevalentie
- Aanpak besmette bedrijven
- Preventie
- Regelgeving
- Websites en literatuur
- Bijlage foto's rund
- Bijlage foto's schaap
Het agens
De veroorzaker van bluetongue is een Orbivirus dat door culicoidesvliegjes wordt verspreid (incidenteel door andere stekende insecten en door het overspuiten van bloed via naalden). Het Orbivirus is een RNA-virus waarvan meer 35 serotypen bekend zijn. De verschillende serotypen veroorzaken allemaal ongeveer hetzelfde ziektebeeld, maar geven onderling geen aanleiding tot kruisimmuniteit. Alleen serotypen 1-24 zijn meldingsplichtig.
Gevoelige diersoorten
Bluetonguevirus veroorzaakt vooral klinische ziektebeelden bij schapen, echter alle herkauwers en camelidae zijn gevoelig en spelen een rol in de epidemiologie. Klinische verschijnselen zijn beschreven bij schapen, runderen, geiten, herten, reeën, rendieren, wisenten en Amerikaanse bisons. Ervaringen in Europese dierentuinen lijken erop te wijzen dat herkauwers van Afrikaanse origine geen klinische verschijnselen vertonen (ook al zijn ze in Europa geboren (persoonlijke communicatie 2009 Christine Kaandorp-Huber als vertegenwoordiger internationale groep dierentuindierenartsen)).
Een verwant virus veroorzaakt epizootic hemoraghic disease (EHD) bij herten. Dit virus kan ook runderen besmetten en klinische verschijnselen veroorzaken sterk lijkend op bluetongue (o.a. uitbraken in USA en Israël beschreven). Een eerste uitbraak van EHD binnen Europa is begin november 2022 vastgesteld bij een aantal runderen op verschillende bedrijven op het eiland Sardinië (Italië) en later op Sicilië en Spanje. Zowel in Italië als in Spanje is het serotype EHDV-8, dat ook voorkomt in Tunesië, aangetoond bij rundvee. Het Ibaraki-virus bij runderen in Japan en Korea is antigenitisch verwant aan EHD.
Volksgezondheid
De mens is niet gevoelig voor het bluetonguevirus.
Desinfectie
Bij bluetongue uitbraken vindt geen ruiming van herkauwers plaats; er is dus geen desinfectie van bedrijfsgebouwen noodzakelijk. Het RNA-virus is gevoelig voor zuren, natrium- en calciumhypochloride (2 – 3%), natriumhydroxide (2%), glutaaraldehyde (2%) en hitte (3 uur bij 50 graden, 15 minuten bij 60 graden of 15 minuten bij 121 graden).
Verschijnselen van Bluetongue
Bluetongue is vooral een klinische aandoening bij schapen. Runderen worden incidenteel klinisch ziek, uitgezonderd bij serotype 8. Het klinisch beeld wordt gekenmerkt door een (ernstige) catarrale ontsteking van de mond, neus en darmen en kreupelheid door ontsteking van de kroonranden en lederhuid. Hoewel de schade door de mortaliteit belangrijk is bij schapen, ontstaat de grootste economische schade door exportbelemmeringen, vruchtbaarheidsproblemen en verlies van de wol.
Klinische verschijnselen
Vermoedelijk varieert het klinisch beeld met het serotype en eventueel bijkomende infecties.
Klinisch beeld bij schapen
De ziekte treedt vooral op in het weideseizoen als de knutten actief zijn (in Nederland van april tot eerste nachtvorsten; hoogste infectiedruk van augustus-oktober). Geïnfecteerd sperma en verticale transmissie zijn verdere besmettingsroutes. Hoe de ziekte tussen de seizoenen overleeft is onduidelijk (b.v overlevende volwassen knutten, toch geringe viruscirculatie in de winterperiode tussen herkauwer en knut, de geboorte van PCR-positieve kalveren/lammeren).
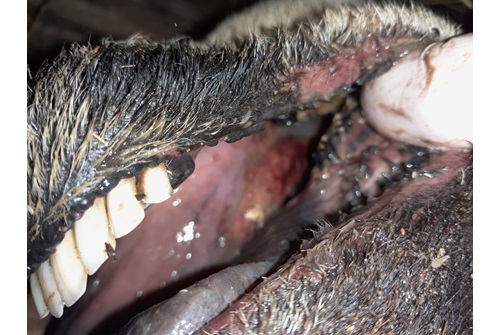
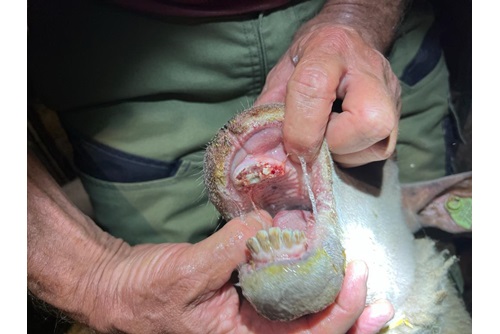
Na een incubatietijd van 5-20 dagen krijgen de dieren hoge koorts (5-6 dagen). Na 48 uur treedt neusuitvloeiing en speekselen op met rode slijmvliezen. De neusuitvloeiing wordt mucopurulent, vaak met bloed- en voerbijmenging, en stinkt. Het speeksel is schuimig. De lippen, tandranden en tong zijn gezwollen en gaan kapot, wat zorgt voor stank, en de tong kan blauw worden. De necrotische laesies zitten vooral aan de zijkant van de tong. Slikken is moeilijk. De ademhaling is door de zwellingen bemoeilijkt en sterk verhoogd in snelheid. Diarree/dysenterie kan optreden. De dieren worden kreupel door ontsteking van de kroonranden (dik, purperrood) en lederhuid. Ook kan ontschoening optreden. Sterfte kan optreden na 6 dagen. Dieren die overleven hebben soms maanden nodig om te herstellen. Daarnaast kunnen de dieren in het chronische stadium sterk vermageren en hun wol (compleet) verliezen. Ook spierverkortingen door verbindweefseling van genecrotiseerd spierweefsel kan optreden. Drachtige ooien kunnen aborteren, ook kunnen lammeren worden geboren met hersenafwijkingen (hydranencephalie, vooral na infectie met door celkweek geadapteerde virussen).
In enzoötische gebieden kunnen 2 beelden optreden. Soms kenmerkt het beeld zich door veel aborterende dieren. Soms treedt onder de lammeren waar de passieve immuniteit afneemt vermagering, zwakte en langzaam herstel op.
Klinisch beeld bij koeien
De ziekte verloopt bij koeien vaak subklinisch, hoewel een aantal dieren de ernstige symptomen van het schaap kunnen vertonen. Koorts (>40), stijfheid en bevangenheid in vier benen, speekselen, lip-oedeem, verminderde eetlust, ooguitvloeiing en stinkende neusuitvloeiing worden gezien. Sommige dieren hebben ulcera op de tong, tandranden en neusspiegel. Kroonrandontsteking en ontschoening worden soms gezien. Abortus kan optreden. Als de moeder de infectie vroeg in de dracht doormaakt, kunnen kalveren geboren worden met aangeboren afwijkingen (hersenen, poten, blind). Bij infectie laat in de dracht (met een aan cellijnen geadapteerd virus) kunnen tot 20% viraemische kalveren worden geboren (viraemie verdwijnt na 1-3 maanden).
Morbiditeit/mortaliteit
In een gevoelige koppel schapen is de morbiditeit bij introductie van het virus 50-75% (in Nederland: 10% in 2006, 15-80% in 2007) en de mortaliteit 20-50%. In latere jaren is de morbiditeit dan 1-2%, de mortaliteit kan dan nog hoog zijn onder jonge schapen.
Bij het rund is de morbiditeit rond de 80% en de mortaliteit rond de 1%.
Uitscheiding van de kiem
De kiem wordt niet of nauwelijks door het dier uitgescheiden met secreta (wel iets met sperma en embryo’s, maar dit is niet erg belangrijk in de epidemiologie). De overdracht vindt plaats via Culicoides (actieve vermenigvuldiging in de knut) en passief via andere stekende insecten en naalden.
Uit onderzoek met bluetonguevirus serotype 8 bleek dat knutten moeilijk te infecteren waren, maar daarna zoveel virus bevatten, dat de steek van één knut voldoende was om een rund te infecteren. Bij de uitbraak in 2007 in Ierland bleek de infectie zich bij runderen ook te verspreiden door vaarzen die de nageboorte van een besmette vaars opvraten.
Differentiaaldiagnostiek
Differentiaaldiagnose bij schapen
- MKZ
- Ecthyma
- Ulceratieve dermatosis
- Sheeppox
- Haemonchose
- Fotosensibiliteit
Differentiaaldiagnose bij runderen
- EHD
- MKZ
- IBR
- MD/BVD
- BCK
- Fotosensibiliteit
- Runderpest (uitgeroeid wereldwijd)
Diagnose van Bluetongue
Pathologie
Het sectiebeeld is niet typisch. Omdat er geen twijfel mag bestaan over de herkomst en identificatie van het dier moet bij een verdenking materiaal (milt) voor onderzoek naar het Wageningen BioVeterinary Research (WBVR, ex CVI) in Lelystad worden gestuurd.
Isolatie van de kiem
Isolatie van het virus is mogelijk uit EDTA-bloed en uit miltweefsel tot ongeveer 60 dagen na infectie. Met behulp van de PCR test van WBVR-Lelystad kan het virus tot 180-220 dagen na infectie in het bloed worden aangetoond (persoonlijke communicatie Piet van Rijn (WBVR)).
Overige testen
- Serologie in serum. Hiermee zijn afweerstoffen aantoonbaar vanaf 8 dagen na infectie. Na natuurlijke infectie blijven de afweerstoffen waarschijnlijk levenslang aanwezig. Maternale afweerstoffen zijn na 4 maanden verdwenen (pilot-onderzoek van GD).
- PCR in EDTA-bloed. Hiermee is antigeen aantoonbaar vanaf 2 dagen na infectie. De PCR blijft positief tot 180-220 dagen na infectie. Het dier is dan al niet meer infectieus, maar antigeen is nog aantoonbaar (persoonlijke communicatie Piet van Rijn (WBVR)).
Prevalentie van Bluetongue
De ziekte komt voor in de ‘zeewarme’ gebieden: Afrika, Midden-Amerika, zuidelijke staten van Noord-Amerika, Australië, Nieuw-Zeeland, Azië, Midden-Oosten, Middellandse Zeelanden. Sedert het jaar 2000 is de ziekte ook geconstateerd in Bulgarije (serotype 9 en 16), Roemenië (serotype 9 en 16), Griekenland (serotype 4 en 16), Sicilië (serotype 1,2,4,9 en 16), Corsica (serotype 4) en Spanje/Portugal (serotype 1,4,8).
Monitoring
Sinds 2009 monitort GD met financiering van het ministerie van LNV jaarlijks circulatie van BTV-virus in naïeve dieren. Dit heeft geleid tot de BTV-vrij status van Nederland in 2012. Ook in 2022 is de jaarlijkse monitoring uitgevoerd, hierbij werden geen (recente) infecties vastgesteld, Op 4 september is door meerdere dierenartsen in Nederland een verdenking van blauwtong gemeld bij de NVWA, welke vervolgens zijn bevestigd.
Nederland
Nederland raakte op 18 augustus 2006 besmet met bluetongue serotype 8. Deze uitbraak heeft zich ook voorgedaan in de omringende landen: Duitsland, België, Luxemburg en Frankrijk. In 2007 heeft de uitbraak – met hetzelfde serotype – zich herhaald en verder uitgebreid naar Engeland, Zwitserland, Denemarken en Polen. De problemen waren toen veel uitgebreider en veel ernstiger. Op basis van onderzoek dat GD heeft uitgevoerd, stierven alleen al in de tweede helft van 2007 ruim 27.000 schapen aan blauwtong. Ruim zestig procent van die sterfte vond in dat jaar plaats in het midden van ons land. In 2008 kwamen nog zestig uitbraken voor, vooral in het noorden. Daarna was de ziekte verdwenen. In 2009 hebben zich geen uitbraken in Nederland meer voorgedaan.
Tussen 18-8-2006 en 15-2-2012 was Nederland besmet met bluetongue serotype 8.
Tussen 21-10-2008 en 6-3-2009 was Nederland besmet met bluetongue serotype 6 (vermoedelijk van vaccinatie-origine).
Op 15 februari 2012 werd Nederland vrij verklaard van bluetongue serotype 8.
Op 4 september 2023 is bij vier schapenhouderijen een besmetting met het blauwtongvirus vastgesteld in de provincies Noord-Holland en Utrecht. Nederland verliest daarmee haar vrijstatus.
Andere landen
In figuur 1 staat een overzicht van blauwtonguitbraken in de EU-lidstaten. België is sinds 5 juni 2023 officieel vrij van blauwtong. Het laatste geval van infectie met serotype 8 van het blauwtongvirus dateerde van februari 2021. Duitsland verkreeg van de Europese Commissie in het voorjaar 2023 eveneens de vrijstatus voor blauwtong voor het hele grondgebied. Luxemburg heeft nog geen vrijstatus. Ook Frankrijk blijft momenteel besmet met blauwtongserotype 8 (BTV8) en serotype 4 (BTV4). Vaccinatie van dieren blijft toegestaan.
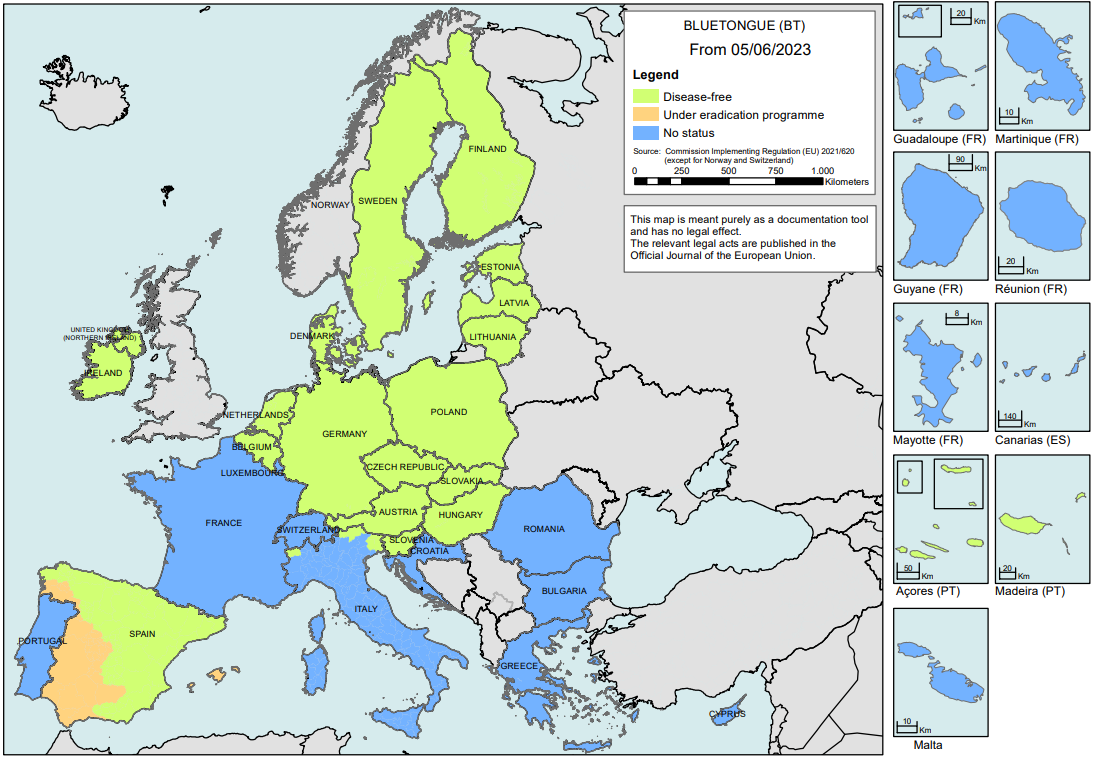
Figuur 1 De toezichtzones per 05-06-2023 (bron: https://food.ec.europa.eu/system/files/2023-06/ad_controlmeasures_bt_restrictedzones-map.pdf)
Gemelde uitbraken in 2021 en 2022
Via Promed zijn in het derde kwartaal van 2022 meldingen van blauwtonguitbraken bij schapen gemeld vanuit verschillende districten in midden Portugal. In Zuid-Portugal is bekend dat zowel BTV1 als BTV4 (donkerblauw gebied, figuur 2) een rol kan spelen. Verder is een uitbraak bij runderen in Spanje gemeld (BTV4) en in Duitsland (BTV8). Beide uitbraken waren in een reeds bekend restrictiegebied. In het vierde kwartaal van 2022 zijn uitbraken gemeld in de regio’s Salamanca en Oropesa in Spanje. De restricties die reeds heersten in de regio Ávila zijn hierdoor uitgebreid naar deze twee regio’s, die voorheen als vrij werden beschouwd (figuur 2). In beide gevallen betreft het uitbraken van het BTV4-serotype bij schapen. Ook op Cyprus zijn eind 2022 drie uitbraken gemeld onder schapen en geiten (BTV4), allen in de regio Famagusta. Sardinië wordt al ruim 20 jaar geraakt door heftige uitbraken van blauwtong bij schapen. In november 2022 staat de teller op 108 uitbraken (tabel 1). Tevens werd vastgesteld dat er naast het endemisch aanwezige BTV1 en BTV4, ook het serotype BTV3 verantwoordelijk was voor uitbraken. Dit serotype wordt op dit moment enkel vastgesteld in (het zuiden van) Sardinië. In tegenstelling tot de andere serotypes is op dit moment geen geïnactiveerd vaccin met BTV3 commercieel beschikbaar.
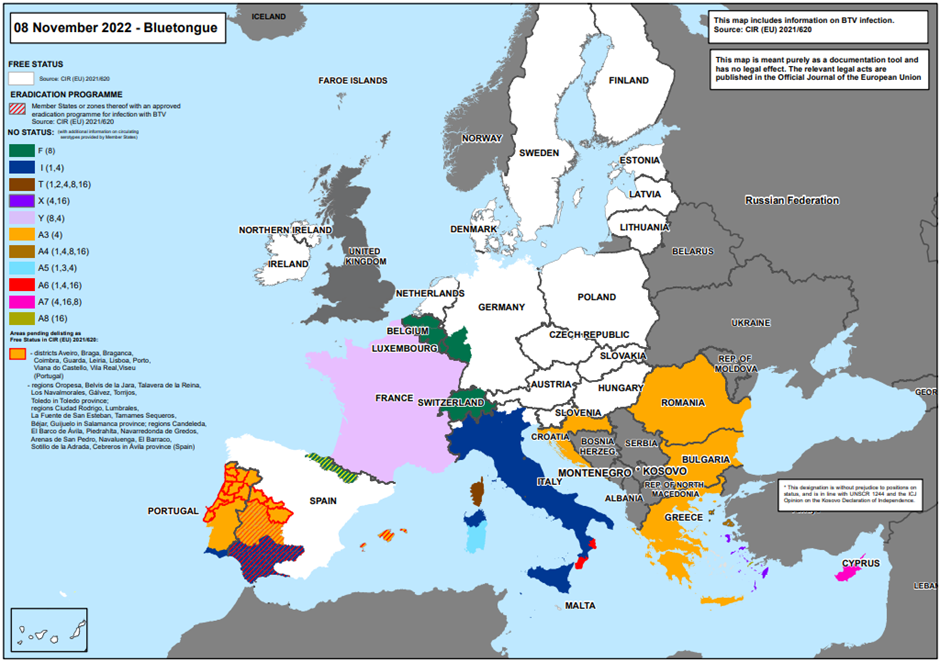
Figuur 2 De toezichtzones per 08-11-2022 en verdeling per blauwtongserotype (bron: https://food.ec.europa.eu/system/files/2022-09/ad_control-measures_bt_restrictedzones-map.pdf)
Tabel 1 Blauwtonginformatie*
|
Land** |
Uitbraken 2021 totaal |
Uitbraken 2022 totaal |
|
België |
3 |
0 |
|
Duitsland |
1 |
0 |
|
Frankrijk |
16 |
0 |
|
Griekenland |
15 |
0 |
|
Italië |
98 |
108*** |
|
Portugal |
24 |
8 |
|
Spanje |
18 |
6 |
|
Zwitserland |
0 |
0 |
|
Luxemburg |
0 |
0 |
|
Noord-Macedonië |
0 |
0 |
|
Montenegro |
0 |
0 |
|
Kroatië |
1 |
0 |
|
Servië |
0 |
0 |
|
Albanië |
0 |
7 |
|
Bosnië & Herzegovina |
0 |
0 |
|
Bulgarije |
2 |
1 |
|
Roemenië |
27 |
0 |
|
Cyprus |
- |
* Bron: websites Animal Disease Information System (ADIS), Promed, https://animal-diseases.efsa.europa.eu/BTV, https://wahis.woah.org/#/event-management.
** Landen worden in de tabel opgenomen zodra in het lopende jaar of de voorgaande twee jaar uitbraken waren.
*** De gemelde uitbraken in Italië betreffen het eiland Sardinië. Op het vasteland van Italië zijn geen uitbaken van Blauwtong gemeld.
Gemelde uitbraken 2020:
- Frankrijk: augustus, een toenemend aantal dieren besmet met het blauwtongvirus serotype 8 (BTV8) gemeld, voornamelijk in het uiterste Zuidwesten van het land. Dit gaat gepaard met duidelijke en ernstige klinische symptomen zoals abortus bij rundvee tot sterfte bij schapen. De geïnfecteerde dieren vertonen een hoge virale belasting (Bron: FAVV).
- Novel Putative Bluetongue Virus Serotype 29 Isolated from Inapparently Infected Goat in Xinjiang of China
Heng Yang 1 , Wenxi Gu 2 , Zhanhong Li 1 , Ling Zhang 2 , Defang Liao 1 , Jianling Song 1 , Shi Baoxin 2 , Jiapaer Hasimu 3 , Zhuoran Li 1 , Zhenxing Yang 1 , Qi Zhong 2 , Huachun Li 1, Transbound Emerg Dis. 2020 Nov 15
Gemelde uitbraken 2019
- Zwitserland: van september tot december rapporteerde Zwitserland 53 uitbraken met BTV-8.
- Frankrijk: vermoedelijke transplacentale infectie door Bluetongue serotype 8 (BTV-8). Sinds half december 2018 meldt Frankrijk kalveren die klein, blind geboren zijn en op enkele dagen oud zijn gestorven. Het gerapporteerde aantal is sinds januari 2019 aanzienlijk toegenomen. Deze dieren zijn positief gebleken door PCR-test op bloed en milt voor BTV-8 (negatief voor Schmallenberg-virus). Deze detectie bij kalveren van ongeveer een week oud tijdens de Culicoides-vectorvrije periode suggereert een transplacentale BTV-8-infectie. Op sommige bedrijven is tussen 2-15% van de pasgeboren kalveren besmet. Transplacentale infectie werd beschreven tijdens de uitbraak van BTV-8 in 2006-2009, maar veel minder dan momenteel gerapporteerd in Frankrijk. Deze waarneming en verdere studies met experimentele muggeninfectie suggereren dat de huidige BTV-8-stam in Frankrijk de Culicoides-vectorcompetentie heeft verminderd (Flannery et al. 2019).
Een studie in Frankrijk is gepubliceerd met schattingen van verticale transmissie bij Frans vee in 2016 m.b.t. infecties die laat in de dracht optreden en de geboorte van levensvatbare kalveren mogelijk maken (Courtejoie et al. 2019). Deze transmissieroute is mogelijk breder is dan verwacht, hoewel de werkelijke epidemiologische impact nog moet worden beoordeeld.
Er moet rekening mee houden worden dat de opnieuw opkomende BTV-8-stam in Noord-Europa transplacentale overdracht en infectie van foetussen bij runderen kan veroorzaken, en BTV-8 moet beschouwd worden als een mogelijke oorzaak van abortus of misvormde kalveren, naast Schmallenberg en andere virussen zoals BVD (bron: www.gov.uk/guidance/bluetongue). - België: sinds maart 2019 is België haar vrij-status kwijt. Eind maart bleek bij de landelijke screening een BTV-8 besmetting opgetreden in zuidoost België, waarop de Belgische regering heeft besloten haar hele grondgebied tot beschermingszone te verklaren, zodat binnen België vrij verkeer van herkauwers mogelijk is.
Begin oktober werd in Zuidoost-België bij een rund voor export het blauwtongvirus BTV-8 aangetoond. Het dier had geen klinische verschijnselen. Omdat het virus werd aangetoond, betekent dit dat de infectie in 2019 heeft plaatsgevonden (maximaal 180 dagen met de PCR aantoonbaar). Eind 2019 waren er veertien gevallen bekend, meestal na uitvoeren van aankooponderzoek. Er zijn nog geen meldingen van klinische symptomen (bron:veescoop DGZ 10/01/2020). - Duitsland: eind 2019 waren er 59 uitbraken van blauwtong (BTV-8) bekend
Door de uitbreiding van BTV-8 naar Duitsland en België is de kans op introductie van BTV-8 in Nederland verder is toegenomen. Dit heeft tot gevolg dat Nederlandse veehouders die vee in de besmette gebieden stallen, de dieren pas kunnen terughalen nadat ze met de PCR-test gunstig zijn onderzocht en een basisvaccinatie hebben gehad. - Voor import van kalveren jonger dan 90 dagen uit België en Duitsland is met betrokken ministeries afgesproken dat aan de volgende gezondheidsbepalingen moet worden voldaan:
- De kalveren zijn met gunstig resultaat getest voor BTV-8 (PCR-test). De test is op zijn vroegst 7 dagen vóór de verplaatsing uitgevoerd.
- De kalveren zijn op het moment van de bloedname behandeld met een uitwendig toe te passen insecticide dat voor gebruik bij runderen is toegelaten.
- Zie voor overige landen en serotypen het kaartje van de Europese website hierboven.
Aanpak besmette bedrijven
Meldingsplichtig
Bluetongue is een meldingsplichtige ziekte volgens uitvoeringsverordening (EU) 2018 /1882 van Animal Health Regulation (AHR) (EU) 2016 /429, categorie C+D+E. Elke verdenking van de ziekte dient te worden gemeld bij de NVWA. De aanpak van besmette bedrijven wordt uitgevoerd volgens de dan geldende draaiboeken.
Vaccinatie
In Noordwest-Europa was vaccinatie tegen serotype 8 sinds 2008 toegestaan met dode vaccins. De vaccins van Merial en Intervet-Sheeringplough (nu MSD Animal Health) waren hiervoor voorlopig geregistreerd in Nederland. In Zuid-Europa wordt actief tegen verschillende serotypen gevaccineerd bij schapen (levend geattenueerde en dode vaccins).
Het gebruik van levend geattenueerde vaccins geeft bij drachtige schapen risico op verwerpen en de geboorte van afwijkende lammeren (hydranenchephalie). Gebruik tijdens het vliegseizoen van de culicoides wordt afgeraden. De mogelijkheid bestaat dan namelijk dat door circulatie van vaccin-virus en verschillende serotypen nieuwe serotypen ontstaan.
Toch is sinds 1-8-2012, door een aanpassing van richtlijn 2000/75/EG, vrijwillige vaccinatie tegen serotype 8 weer toegestaan, mits met een geregistreerd en niet-levend BTV-8 vaccin.
Antibiotica
Niet van toepassing. Alleen ondersteunend tegen secundaire infecties. Elke verdenking van bluetongue dient te worden gemeld bij NVWA. NVWA zorgt voor monstername, zodat de infectie kan worden aangetoond of uitgesloten. Als een dier eenmaal is besmet, is behandeling niet mogelijk. Een behandeling van de symptomen, aangevuld met antibiotica tegen secundaire bacteriële infecties, kan het lijden wat verlichten.
Overige maatregelen
Het risico van besmetting met bluetongue hangt nauw samen met de activiteiten en de leefomstandigheden van de belangrijkste virusverspreider, de knut.
Zo neemt het risico van een bluetongue-besmetting toe:
- in de periode van eind mei tot eind oktober, als de volwassen knutten vliegen;
- tussen zonsondergang en zonsopgang (inclusief de schemering);
- in (de buurt van) een vochtige omgeving dat organisch materiaal bevat (plassen, poelen, langzaam stromend water), waar de knutten zich voortplanten.
Preventieve maatregelen tegen bluetongue zijn het opstallen gedurende de schemering en de nacht (bij paarden met staart-en-manen eczeem werkt dit zeer effectief). Uit onderzoek van de GD blijkt dat bedrijven met een beperkt aantal weide-uren en bedrijven met stallen met grote lucht-inlaat-openingen (>30 cm) een lagere prevalentie van bluetongue hebben.
Programma’s buitenland
Geen, buiten vaccinatie.
Preventie van Bluetongue
Opstallen en mechanische overdruk-ventilatie dragen bij het aan het beperken van het risico op contact met knutten. Monitoring in vrije gebieden draagt bij aan een vroege signalering (zodat tijdig gevaccineerd kan worden om spreiding te voorkomen).
Regelgeving
Vanaf 21 april 2021 is de nieuwe Europese diergezondheidsverordening, of Animal health regulation (AHR) van toepassing. Met deze verordening wordt de aanpak van dierziekten binnen de Europese Unie meer met elkaar in overeenstemming gebracht. Voor zover de AHR geen rechtstreekse werking heeft, is deze in Nederland per 21 april 2021 geïmplementeerd in of op basis van de Wet Dieren. Iedere lidstaat is verplicht om een monitoringsysteem uit te rollen voor het opsporen van door de EU aangewezen ziekten en relevante nieuwe ziekten.
Op basis van de AHR worden in Uitvoeringsverordening (EU) 2018/1882 van de commissie van 3 december 2018 dierziekten gecategoriseerd en ingedeeld in A-, B-, C-, D- en E-ziekten.
Bluetongue valt in categorie C+D+E:
- C. Dierziekten die relevant zijn voor sommige lidstaten en waarvoor maatregelen nodig zijn om te voorkomen dat zij zich verspreiden naar andere delen van de Unie die officieel ziektevrij zijn of waarin een uitroeiingsprogramma voor de dierziekte loopt;
- D. Dierziekten waarvoor maatregelen nodig zijn om te voorkomen dat zij zich verspreiden wegens binnenkomst in de Unie of verplaatsingen tussen de lidstaten;
- E. Dierziekten waarvoor bewaking nodig is binnen de Unie zijn.
De bestrijdingsplicht bluetongue vervalt hiermee. Na 21 april 2021 is het een vrijwillig te bestrijden dierziekte, waarvoor dus wel een officiële vrijstatus mogelijk is. NL is sinds 2012 vrij van BTV en zal per 21 april daarom officieel BTV-vrij zijn. Wel blijft de jaarlijkse monitoring verplicht. Principebesluit is om geen verplichte bestrijding te starten bij besmetting. NL verliest in dat geval de vrijstatus.
Bij (verdenking van) een uitbraak van bluetongue dient de betrokken dierenarts of veehouder dit melden melding bij de NVWA https://www.nvwa.nl/onderwerpen/dierziekten/melden-dierziekte#/
Websites en literatuur
Websites
- Member States’ information on the derogations from the BTV requirements for movements within the EU:
https://ec.europa.eu/food/animals/animal-diseases/control-measures/bluetongue - BLUETONGUE: protocol vervoer herkauwers (Versie: 2.0.9 21-01-2022):
- www.oie.int
- http://www.defra.gov.uk/animal-diseases/a-z/bluetongue/
- http://www.cfsph.iastate.edu/DiseaseInfo/disease.php?name=bluetongue&lang=en
Literatuur
- Backx, A., Heutink, C.G., Van Rooij, E.M.A., and Van Rijn, P.A., 2007.
Clinical signs of Bluetongue virus serotype 8 infection in sheep and goats. Vet. Record. 161, 591-593. - Backx, A., Heutink, R., Van Rooij, E.M.A., Van Rijn, P.A., 2009.
Transplacental and oral transmission of wild-type bluetongue virus serotype 8 in cattle after experimental
infection. Vet. Mic.138, 235-243. - Baldet, T., Delécolle, J.C., Cêtre-Sossah, C., Mathieu, B., Meiswinkel, R., Gerbier, G., 2008.
Indoor activity of Culicoides associated with livestock in the bluetongue virus (BTV) affected
region of northern France during autumn 2006. Prev. Vet. Med. 87, 84-97. - Batten, C., Darpel, K., Veronesi, E., Williamson, S., Anderseon, P., Dennison, M., Clifford, S., Smith, C., Phillips, L., Bachanek-Bankowska, K., Sanders, A., Bin-Tarif, A., Wilson, A., Gubbins, S., Mertens, P., Oura, C., Mellor, P., 2009.
Transplacental transmission of bluetongue serotype 8 (BTV-8) in the United Kingdom (2007-2008). In proceedings of Epizone, 3rd edition. 12-15 May 2009 Antalya, Turkey. - Baylis, M., Parkin, H., Kreppel, K., Carpenter, S., Mellor, P.S., McIntyre, K.M., 2009.
Evaluation of housing as a means to protect cattle from Culicoides biting midges, the vectors of bluetongue virus.
In: Proceedings of the 12th International Symposium on Veterinary Epidemiology and Economics (ISVEE), 10-14 August 2009, Durban, South Africa. - Bekker, J.G., De Kock, G.V.D.W., Quinlan, J.B., 1934. The occurrence and identification of bluetongue in cattle- the so-called pseudo-foot and mouth disease in South Africa. Vet. Res. 2, 393-507.
- Bonneau, K.R., Zhang, N., Zhu, J., Zhang, F., Li, Z., Zhang, K., Xiao, L., Xing, W., MacLachlan, N.J., 1999.
Sequence comparison of the L2 and S10 genes of bluetongue virus from the
United States and the People’s Republic of China. Virus Res. 61, 153-160. - Bonneau, K.R., Demaula, C.D., Mullens, B.A., MacLachlan, N.J., 2002.
Duration of viraemia infectious to Culicoides sonoris in bluetongue virus-infected cattle and sheep.
Vet. Mic. 88, 115-125. - Borkent, A., Wirth, W.W., 1997. World species of biting midges (Diptera: Ceratopogonidae).
Bull. Am. Museum of Nat. Hist. 233, 1-257. - Bournez, L., Cavalerie, L., Sailleau, C., Bréard, E., Zanella, G., Servan de Almeida, R., Pedarrieu, A., Garin, E., Tourette, I., Dion, F., Hendrikx, P., and Calavas, D., 2018. Estimation of French cattle herd immunity against bluetongue serotype 8 at the time of its re-emergence in 2015. BMC Veterinary Research 14:65
- Bowne, J.G., Luedke, A.J., Jochim, M.M., 1967. Bluetongue of sheep and cattle: past, present and future.
J. Am. Vet. Med. Ass. 151, 1801-1803. - Braverman, Y., Linley, J.R., Marcus, R., Frish, K., 1985. Seasonal survival and expectation of infective life of Culicoides spp.
(Diptera: Ceratopogonidae) in Israel, with implications for bluetongue virus transmission and a comparison of the parous rate in C. imicola from Israel and Zimbabwe. J. of Med. Entomol. 22, 476-484. - Calistri, P., Giovannini, A., Conte, A., Nannini, D., Santucci, U., Patta, C., Rolesu, S., Caporale, V., 2004. Bluetongue in Italy: Part I. Vet. Ital. 40, 243-251.
- Caracappa, S., Torina, A., Guercio, A., Vitale, F., Calabro, A., Purpari, G., Ferrantelli, V., Vitale, M., Mellor, P.S., 2003. Identification of a novel bluetongue virus vector species of Culicoides in Sicily. Vet. Rec. 153, 71-74.
- Carpenter, S., Szmaragd, C., Barber, J., Labuschagne, K., Gubbins, S., Mellor, P., 2008. An assessment of Culicoides surveillance techniques in northern Europe: have we underestimated a potential bluetongue virus vector. J. Appl. Ecol. 45,1237-1245.
- CEC, 2000. Council Directive 2000/75/EEC of 20 November 2000 laying down specific provisions for the control and eradication of bluetongue. In Official Journal of the European Communities, pp. 74–83.
- CEC, 2005. Commission Decision of 23 May 2005 on protection and surveillance zones in relation to bluetongue and conditions applying to movements from or through these zones.
In Official Journal of the European Communities, pp. 22–31. - Courtejoie, N., Bournez, L., Zanella, G., and Durand, B., 2019. Quantifying bluetongue vertical transmission in French cattle from surveillance
- Data. Vet Res (2019) 50:34Darpel, K.E., P. Monaghan, S.J. Anthony, H. Takamatsu, and P.P. Mertens. 2009.
Bluetongue virus in the mammalian host and the induced immune response.
In: Bluetongue, P. Mellor, M. Baylis, and P. Mertens, Eds, Elsevier, London, pp. 265-284. - Dercksen, D., Lewis, C., 2007. Bluetongue virus serotype 8 in sheep and cattle: a clinical update. In practice 29, 314-318.
- Demaula, C.D., Leutenegger, C.M., Bonneau, K.R., MacLachlan, N.J., 2002.
The role of endothelial cell-derived inflammatory and vasoactive mediators in the pathogenesis of bluetongue. Virol. 296, 330-337. - EFSA, 2007. Scientific report of the scientific panel on animal health and welfare on request from the commission (EFSA-Q-2006-311) and EFSA selfmandate (EFSA-Q-2007-063) on Bluetongue.
The EFSA journal, 479, 1-29 and 480 1-20. - Elbers, A.R.W., Rijn Van, P.A., Rooij Van, E.M.A., 2003. Attempt to a risk analysis regarding the introduction of bluetongue virus and west nile virus in the Netherlands, in Dutch. CIDC-rapport 2003-02,
http://www.cvi.wur.nl/NR/rdonlyres/CC4EC0FD-3F41-4C98-A2A5-E08903091408/11385/RiskAssessmentBT.pdf, accessed on 20-08-2010. - Elbers, A.R.W., Backx, A., Meroc, E., Gerbier, G., Staubach, C., Hendrickx, G., Spek Van der, A., Mintiens, K., 2008a. Field observations during the bluetongue serotype 8 epidemic in 2006. I.
Detection of first outbreaks and clinical signs in sheep and cattle in Belgium, France and the Netherlands. Prev. Vet. Med. 87, 21-30. - Elbers, A.R.W., Backx, A., Meroc, E., Gerbier, G., Staubach, C., Hendrickx, G., Spek Van der, A., Mintiens, K., 2008b. Field observations during the bluetongue serotype 8 epidemic in 2006. II.
Morbidity and mortality rate, case fatality and clinical recovery in sheep and cattle in the Netherlands. Prev. Vet. Med. 87, 31-40. - Elbers, A.R.W., Backx, A., Ekker, H.M., Spek Van der, A., Rijn Van, P.A., 2008c. Performance of clinical signs to detect bluetongue virus serotype 8 outbreaks in cattle and sheep during the 2006-epidemic in The Netherlands. Vet. Mic. 129, 156-162.
- Elbers, A.R.W., Van der Spek, A.N., Van Rijn, P.A., 2009. Epidemiologic characteristics of bluetongue virus serotype 8 laboratory-confirmed outbreaks in the Netherlands in 2007 and a comparison with the situation in 2006. Prev. Vet. Med. 92, 1-8.
- Elbers, A.R.W., de Koeijer, A.A., Scolamacchia, F., Van Rijn, P.A., 2010. Motives of commercial livestock farmers and hobby holders to vaccinate during a voluntary vaccination campaign against Bluetongue virus serotype 8 in 2008-2009 in the Netherlands.
Vacc. 29, 2473-2481. - Elbers, A.R.W., R. Meiswinkel, 2014 .Culicoides (Diptera: Ceratopogonidae) host preferences and biting rates in the Netherlands: Comparing cattle, sheep andthe black-light suction trap. Veterinary Parasitology 205 (2014) 330–337
- Erasmus, B.J., 1975. Bluetongue in sheep and goats. Aust. Vet. J. 51, 65-170.
- European regulation 1266/2007, 2007. on implementing rules for Council Directive 2000/75/EC as regards the control, monitoring, surveillance and restrictions on movements of certain animals of susceptible species in relation to bluetongue.
http://eur-lex.europa.eu/LexUriServ/site/en/oj/2007-/l_283/l_28320071027en00370052.pdf, accessed on 12-06-2010. - Flannery, J., Sanz‐Bernardo, B., Ashby, M., Brown, H., Carpenter, S., Cooke, L., Corla, A., Frost, L., Gubbins, S., Hicks, H., Qureshi, M., Rajko‐Nenow, P., Sanders, C., Tully, M., Bréard, E., Sailleau, C., Zientara, S., Darpel, K. and Batten, C. 2019. Evidence of reduced viremia, pathogenicity and vector competence in a re‐emerging European strain of bluetongue virus serotype 8 in sheep. Transboundary and Emerging Diseases, online 20 January 2019, doi: 10.1111/tbed.13131
- Galleau, S., Hamers, C., Blosse, A., Bolon, A., Blanchet, M., Goutebroze, S. 2009. Can vaccination prevent transplacental transmission of BTV-8. In proceedings of Epizone, 3rd edition. 12-15 May 2009 Antalya, Turkey.
- Gerdes, G.H., 2004. A South African overview of the virus, vectors, surveillance and unique features of bluetongue. Vet. Ital. 40, 39–42.
- Gerry A.C., Mullens B.A., 2000. Seasonal abundance and survivorship of Culicoides sonorensis (Diptera: Ceratopogonidea) at a southern California dairy, with reference to potential Bluetongue virus transmission and persistence.
J. of medical entomol. 37:675-688. - Gerry, A., Mullens, B., MacLachlan, N.J., Mecham, J., 2001. Seasonal transmission of bluetongue virus by Culicoides sonoresis (Diptera: Ceratopogonidae) on a southern California dairy and evaluation of vectorial capacity as a predictor of virus transmission.
J. Med. Entomol. 38, 197-209 - Gerbier, G., Baldet, T., Hendrickx, G., Mintiens, K., Elbers, A., Staubach, C., Modelling local dispersal of bluetongue virus serotype 8 using random walk. Prev. Vet. Med. 87, 119-130.
- Gibbs, E.P., Greiner, E.C., 1994. The epidemiology of bluetongue. Comp. Immunol. Mic. and Infect. Dis. 17, 197-206.
- Giovannini, A., Calistri, P., Nannini, D., Paladini, C., Santucci, U., Patta, C., Caporale, V., 2004. Bluetongue in Italy: Part II. Vet. Ital. 40, 252-259.
- Green, A.L., Dargatz, D.A., Schmidtmann, E.T., Herrero, M.V., Seitzinger, A.H., Ostlund, E.N., Wagner, B.A., Moser, K.M., Wineland, N.E., Walton, T.E. 2005.
Risk factors associated with herd-level bluetongue virus exposure of cattle in Nebraska, North Dakota, and South Dakota. American Journal of Veterinary Research. 66: 853-860. - Gubbins, S., Carpenter, S., Baylis, M., Wood, J.L.N., Mellor, P.S., 2008. Assessing the risk of bluetongue to UK livestock: uncertainty and sensitivity analysis of a temperature-dependent model for the basic reproduction .
J. R. Soc. Interface 5:363-371. - Gubbler, D.J., 1991. Insects in Disease transmission. In: Gubbler, D.J., 1998. Resurgent vector-borne diseases as a global health problem. Em. Infect. Dis. 4, 442-450.
- Hartemink, N.A., Purse, B.V., Meiswinkel, R., Brown, H.E., de Koeier, A., Elbers, A.R.W., Boender, G. J., Rogers, D.J., Heesterbeek, J.A.P., 2009.
Mapping the basic reproduction (R0) for vector-borne diseases; a case study on bluetongue virus. Epidem. 1:153-161. - Jubb, K.V.F., Kennedy, P.C., 1970. Bluetongue. In pathology of domestic animals. New York Academic press. 2, 10-14.
- Koeijer de, A.A., Elbers, A.R.W., 2008. Modelling of vector-borne diseases and transmission of bluetongue virus in North-West Europe.
In: Emerging pests and vector-borne diseases in Europe. Wageningen Academic Publishers, Wageningen, pp. 99-112. - Haresnape, J.M., Taylor, W.P., Lungu, S.A.M., 1988. The epidemiology of blueto ngue in Malawi. Epidemiol. Infect. 100, 493-499.
- Hofmann, M.A., Renzullo, S., Mader, M., Chaignat, V., Worwa, G., Thuer, B., 2008. Genetic characterization of Toggenburg orbivirus a new bluetongue virus, from goats, in Switzerland. Em. Infect. Dis. 14, 1855-1861.
- Hoogstrall, H., 1979. The epidemiology of tick- born Criemen-Congo Hemorrhagic fever in Asia, Europe and Africa. L. Med. Entamol. 15, 307-417.
- Howell, P.G., Verwoerd, D.W., 1971. Bluetongue virus. In: S. Gard, C. Hallaver and K.F. Meyer, Editors, Virology monographs, Vol 9 springer Verlag, New York, 35-70.
- Hutcheon, D., 1881. Fever of epizootic catarrh. Rept. Coll. Vet. Surg. 12.Laughlin, L.W., Meegan, J.M., Strausbauch, L.J., Morens, D.M., Watten, R.H., 1979.
Epidemic Rift Valley Fever in Egypt : obserbvations of the spectrum of human illness. Tropical Medicine and hygiene, 73, 630-633. - Kramps, J.A., Van Maanen, K., Mars, M.H., Popma, J.K., Van Rijn, P., 2008. Validation of a commercial ELISA for the detection of bluetongue virus (BTV)-specific antibodies in individual milk samples of Dutch dairy cows. Vet. Mic. 130, 80-87.
- Le Gal, M.C., Dufour, B., Geoffroy, E., Zanella, G., Moutou, F., Milleman, Y., Rieffel, J.N., Pouilly, J.N., 2008. Bluetongue virus serotype 8 in the Ardennes in 2007. Vet. Rec. letter 29 November 2008.
- LNV, 2006a. Regulation TRCJZ/2006/2750 regarding bluetongue restriction zones in 2006. http://www.minlnv.nl/portal/page?_pageid=116,1640321&_dad=portal&_schema=PORTAL&p_file_id=16106. Accessed on 17-05-2010.
- Meiswinkel, R., Goffredo, M., Dijkstra, E.G.M., Ven van der, I.J.K., Baldet, T., Elbers, A., 2008. Endophily in Culicoides associated with BTV-infected cattle in the province of Limburg, south-eastern Netherlands, 2006. Prev. Vet. Med. 87, 182-195.
- LNV, 2006b. Bluetongue monitoring and surveillance in the Netherlands. Dutch ministry of agriculture, nature and fisheries, www.minlnv.nl/txmpub/files/?p_file_id=16706 accessed on 22-09-2010.
- MacLachlan, N.J., Osburn, B.I., 1983. Bluetongue virus-induced hydranencephaly in cattle. Vet. Pathol. 20, 563-573.
- Maclachlan, N.J., Conley, A.J., Kennedy, P.C., 2000. Bluetongue and equine viral arteritis viruses as models of virus-induced fetal injury and abortion. Anim. Reprod. Sci. 60-61, 643-651.
- MacLachlan, N.J., 2004. Bluetongue: pathogenesis and duration of viraemia. Vet. Ital. 40, 462-467.
- Marfin, A.A., Petersen, L.R., Eidson, M., Miller, J., Hadler, J., Farello, C., 2001. Widespread West Nile virus activity, Eastern United States, 2000. Emerg. Infect. Dis. 7, 730–735.
- Mars, M.H., Van Maanen, C., Vellema, P., Kramps, J.A., Van Rijn, P. A., 2010. Evaluation of an indirect ELISA for detection of antibodies in bulk milk against bluetongue virus infections in the Netherlands. Vet. Mic. In press.
- Mastroyanni, M., Axiotis, I., Stoforos, E., 1981. Study of the first outbreak of bluetongue disease in sheep in Greece. Bull. Hell. Vet. Ass. 32, 138-144.
- Meiswinkel, R., Baylis, M., Labuschagne, K., 2000. Stabling and the protection of horses from Culicoides bolitinos (Diptera: Ceratopogondiae), a recently identified vector of African horse sickness. Bull. Entomol. Res. 90, 509-515.
- Meiswinkel, R., Paweska, J.T., 2003. Evidence for a new field Culicoides vector of African horse sickness in South Africa. Prev. Vet. Med. 60, 243–253.
- Meiswinkel, R., Gomulski, L.M., Delécolle, J.-C., Goffredo, M., Gasperi, G., 2004. The taxonomy of Culicoides vector complexes-unfinished buiness. Vet. Ital. 40, 151-159.
- Meiswinkel, R., Van Rijn, P., Leijs, P., Goffredo, M., 2007. Potential new Culicoides vector of bluetongue virus in northern Europe. Vet. Rec. 161, 564-565.
- Meiswinkel, R., Baldet, T., De Deken, R., Takken, W., Delécolle, J.-C., Mellor, P.S., 2008a. The 2006 outbreak of bluetongue in nortern Europe- The entomological perspective. Prev. Vet. Med. 87, 55-63.
- Meiswinkel, R., Goffredo, M., Leijs, P., Conte, A., 2008b. The Culicoides ‘snapshot’: A novel approach used to asses vector densities widely and rapidly during the 2006 outbreak of bluetongue (BT) in the Netherlands. Prev. Vet. Med. 87, 98-118.
- Meiswinkel, R., Goffredo, M., Dijkstra, E.G.M., Ven van der, I.J.K., Baldet, T., Elbers, A., 2008c. Endophily in Culicoides associated with BTV-infected cattle in the province of Limburg, south-eastern Netherlands, 2006. Prev. Vet. Med. 87, 182-195.
- Mellor, P.S., Carpenter, S., Harrup, L., Baylis, M., Mertens, P.P.C., 2008. Bluetongue in Europe and the Mediterranean Basin: History of occurrence prior to 2006. Prev. Vet. Med. 87, 4-20.
- Menzies, F.D., McCullough, S.J., McKeown, I.M., Forster, J.L., Jess, S., Batten, C., Murchie, A.K., Gloster, J., Fallows, J.G., Pelgrim, W., Mellor, P.S., Oura, C.A.L., 2008.
Evidence for transplacental and contact transmission of bluetongue virus in cattle. Vet. Rec. 163, 203-209. - Mertens, P.P., Diprose, J., Maan, S., Singh, K.P., Attoui, H., Samuel, A.R., 2004. Bluetongue virus replication, molecular and structural biology. Vet. Ital. 40,426-437.
- Mintiens K., Méroc, E., Faes, C, Cortiñas Abrahantes, J., Hendrickx, G., Staubach, C., Gerbier, G., Elbers, A.R.W., Aerts, M., De Clercq, K., 2008.
Impact of human interventions on the spread of bluetongue virus serotype 8 during the 2006 epidemic in north-western Europe. Prev. Vet. Med. 87, 145–161. - Mullens, B.A., Gerry, A.C., Velten, R.K., 2001. Failure of a permethrin treatment regime to protect against bluetongue virus. J. of Vet. Entomol. 38, 760-762.
- Mo, C.L., Thompson, L.H., Homan, E.J., Oviedo, M.T., Greiner, E.C., González, J., Sáenz, M.R., 1994. Bluetongue virus isolations from vectors and ruminants in Central America and the Caribbean.
Interamerican Bluetongue Team. Am J Vet Res. 55, 211-216. - Moorman, R., 2008. Research programme emerging vector-borne viral diseases at the central veterinary institute. In: proceedings symposium everging vector borne viral diseases on the 28th of November 2008, Lelystad, The Netherlands.
- Muskens, J., Van Wuijckhuise, L., Van Rijn, P., Vellema, P., 2010. Monitoring BTV-8 virus circulation in 2009, in Dutch. Project 2080028, GD Deventer, the Netherlands.
- Nevill, E.M., 1971. Cattle and Culicoides biting midges as possible overwintering hosts of bluetongue virus. Onderstepoort J. of Vet. Res. 38, 65-72.
- Nomikou, K., Mangana-Vougiouka, O., Panagiotatos, D.E., 2004. Overview of bluetongue in Greece. Vet. Ital. 40, 108-115.
- Paweska, J.T., Venter, G.J., Mellor, P.S., 2002. Vector competence of South African Culicoides species for bluetongue virus serotype 1 (BTV-1)
with special reference to the effect of temperature on the rate of virus replication in C. imicola and C. bolitinos (Diptera:Ceratopogonidae). Med. And Vet. Entomol. 16, 10-21. - O’Connell, L., 2002. Entomological aspects of the transmission of arboviral diseases by Culicoides biting midges. PhD, thesis, University of Bristol.
- OIE, 2010a. OIE listed diseases: http://www.oie.int/eng/maladies/en_classification2010.htm?e1d7, accessed on 31-08-2010.
- OIE, 2010b. Disease distribution maps: Bluetongue: http://www.oie.int/wahis/public.php?page=disease_status_map&disease_type=Terrestrial&disease_id=9
&disease_category_terrestrial=0&empty=999999&disease_category_aquatic=0&disease_serotype=0&sta_method=semesterly&selected_start_year=2010&selected_report_period=1&selected_start_month=1&page=disease_status_map&date_submit=OK, accessed on 15-05-2010. - OIE, 2010c. Terrestrial Animal Health code, Chapter 8.3. Bluetongue. www.oie.int/eng/normes/mcode/en_chapitre_1.8.3.pdf,
accessed on 23-09-2010. - Özer, N., 2005. Emerging vector-borne diseases in a changing environment. Turk. J. Biol. 29, 125-135.
- Parsonon, I.M., 1990. Pathology and pathogenesis of bluetongue infections. Curr. Top. Microbiol. Immunol. 162, 119-141.
- Pritchard, L.I., Sendow, I., Lunt, R., Hassan, S.H., Kattenbelt, J., Gould, A.R., Daniels, P.W., Eaton, B.T., 2004. Genetic diversity of bluetongue viruses in South East Asia. Virus Res. 101, 193-201.
- Purse, B.V., Nedelchev, N., Georgiev, G., Velveva, E., Boorman, J., Veronesi, E., Carpenter, S., Baylis, M., Mellor, P.S., 2206. Spatial and temporal distribution of bluetongue and its Culicoides vecors in Bulgaria. Med. Vet. Entomol.. 20, 335-344.
- Tabachnik, W., 2004. Culicoides and the global epidemiology of bluetongue virus infection. Vet. Ital. 40, 145-150.
- Toussaint, J.F., Vandenbussche, F., Mast, J., Demeestere, L., Goris, N., Van Dessel, W., Vanopdenbosch, E., Kerkhofs, P., Zientara, S., Sailleau, C., Czaplicki, G., Depoorter, G., Dochy, J.M., De Clercq, K., 2006. Bluetongue in northern Europe. Vet.Rec. 159, 327.
- Saegerman, C., Mellor, P., Uyttenhoef, J-B. H., Kirschvink, N., Haubruge, E., Delcroix, P., Houtain, J-Y., Pourquier, P., Vandenbussche, F., Verheyden, B., De Clercq, K., Czaplicki, G., 2010. The Most Likely Time and Place of Introduction of BTV8 into Belgian Ruminants. Plos One, http://www.plosone.org/article/info:doi/10.1371/journal.pone.0009405;jsessionid=
3CC91B1C7D02B4C85883721168D3AB75, accessed on 23-05-2010. - Santman-Berends, I.M.G.A., Stegeman, J.A., Vellema, P., Schaik van, G., 2013. Estimation of the reproduction ratio (R(0)) of bluetongue based on serological field data and comparison with other BTV transmission models. Prev. Vet. Med. 108, 276-284.
- Santman-Berends, I.M.G.A., Hage, H., Lam, T.J.G.M., Sampimon, O.C., Schaik van, G., 2010. The effect of bluetongue virus serotype 8 on milk production and somatic cell count in Dutch dairy cows in 2008. J. Dairy Sci. 94, 2476-2484.
- Santman-Berends, I.M.G.A., Schaik van, G., Bartels, C.J.M., Stegeman, J.A., Vellema, P., 2010. Mortality attributable to bluetongue virus serotype 8 infection in Dutch dairy cows. Vet. Mic. 148, 183-188.
- Santman-Berends, I.M.G.A., Hage, J.J., Rijn van, P.A., Stegeman¬, J.A., Schaik van, G., 2010.
BTV-8 in Dutch cows in 2008; fertility performance and the infection status of the offspring. Theriogenology. 74, 1377-1384. - Santman-Berends, I.M.G.A., Bartels, C.J.M., van Schaik, G., Stegeman, J.A., Vellema. P., 2010.
The increase in seroprevalence of bluetongue virus (BTV) serotype 8 infections and associated risk factors in Dutch dairy herds, in 2007. Vet. Mic. 142:268-275. - Santman-Berends, I.M.G.A., van Wuijckhuise, L., Vellema, P., van Rijn, P. A., 2009.
Vertical transmission of bluetongue virus serotype 8 virus in Dutch dairy herds in 2007. Vet. Mic. 141:31-35. - Savini, G., Goffredo, M., Monaco, F., De Santis, P., Meiswinkel, R., 2003. Transmission of bluetongue virus in Italy. Vet. Rec. 152, 119. SCoFCAH, 2007. Presentations European countries December 2006. http://www.knmvd.nl/resources/AMGATE_7364_1_TICH_R34591068822708//, accessed on 17-05-2010.
- Shimshony, A., 2004. Bluetongue in Israel: a brief historical overview. Vet. Ital. 40, 116-118.
- Spreull, J., 1905. Malarial catarrhal fever (bluetongue) of sheep in South Africa. J. Comp. Pathol. Therapy 18, 321-337.
- Sreenivasulu, D., Subba Rao, M.V., Reddy, Y.N., Gard, G.P., 2004. Overview of bluetongue disease, viruses, vectors, surveillance and unique features: the Indian subcontinent and adjacent regions. Vet. Ital. 40, 73-77.
- Stallnecht, D.E., Howerth, E.W., 2004. Epidemiology of bluetongue and epizootic disease in wildlife: surveillance methods. Vet. Ital. 40, 203-207.
- Van Schaik, G., Berends, I.M.G.A., Van Langen, H., Elbers, A.R.W., Vellema, P., 2008. Seroprevalence of bluetongue serotype 8 in cattle in the Netherlands in spring 2007, and its consequences. Vet. Rec. 163, 441-444.
- Van Wuijckhuise, L., Dercksen, D., Muskens, J., Bruijn de , J., Scheepers, M., Vrouenraets, R., 2006. Bluetongue in the Netherlands; description of the first clinical cases and differential diagnosis. Common symptoms just a little different and in too many herds. Tijdschr. Diergeneeskd. 131, 649-654.
- Van Wuijckhuise, L., Bartels, C., Wouda, W., Kock, P., 2007. Cattle health surveillance in the Netherlands (2). In proceedings of the Interanational conference of the Canadian Association of Veterinary Epidemiology and Preventive Medicine, 6-15 June 2007, Edmonton Canada.
- Vellema, P., 2008. Bluetongue in sheep: question marks on bluetongue serotype 8 in Europe. Small Ruminant Res. 76, 141-148.
- Venter, G.J., Paweska, J.T., Van Dijk, A.A., Mellor, P.S., Ick, W.J.T., 1998. Vector competence pf Culicoides bolitinos and C. imicola for South African bluetongue virus serotypes 1, 3 and 4. Med. and Vet. Entomol. 12, 378-385.
- Velthuis, A.G.J., Saatkamp, H.W., Mourits, M.C.M., de Koeijer, A.A., Elbers, A.R.W., 2009.
Financial consequences of the Dutch bluetongue serotype 8 epidemics of 2006 and 2007. Prev. Vet. Med. 93, 294-304. - Wäckerlin, R., Eschbaumer, M., König, P., Hoffmann, B., Beer, M., 2010. Evaluation of humoral response and protective efficacy of three inactivated vaccines against bluetongue virus serotype 8 one year after vaccination of sheep and cattle. Vacc. 28, 4348-4355.
- Walton., T.E., 2004. The history of bluetongue and a current global overview. Vet. Ital. 40, 31-31.
- Ward, M.P., Thurmond, M.C., 1995. Climatic factors associated with risk of seroconversion of cattle to bluetongue viruses in Queensland. Prev. Vet. Med. 24, 129-136.
- Williamson S., Woodger, N., Darpel, K., 2008. Differential diagnosis of bluetongue in cattle and sheep. In practice 30, 242-251.
- Wouda, W., Roumen, M.P.H.M., Peperkamp, N.H.M.T., Vos, J.H., Van Garderen, E., Muskens, J., 2008. Hydranencephaly in calves following the bluetongue serotype 8 epidemic in the Netherlands. Vet. Rec. 162:422-423.
- Zhang, N., MacLachlan, N.J., Bonneau, K.R., Zhu, J., Li, Z., Zhang, K., Zhang, F., Xia, L., Xiang, W., 1999. Identification of seven serotypes of bluetongue virus from the people’s Republic of China. Vet. Rec. 145, 427-429.
Bijlage: foto's rund
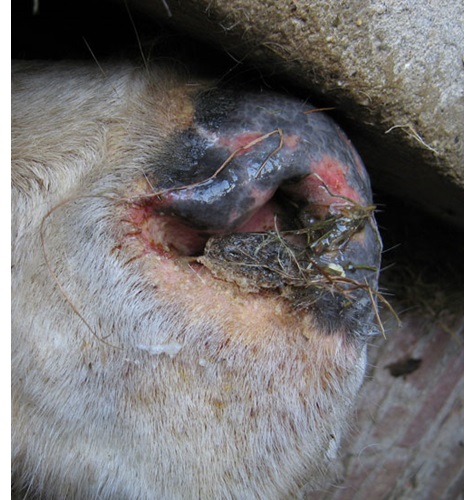
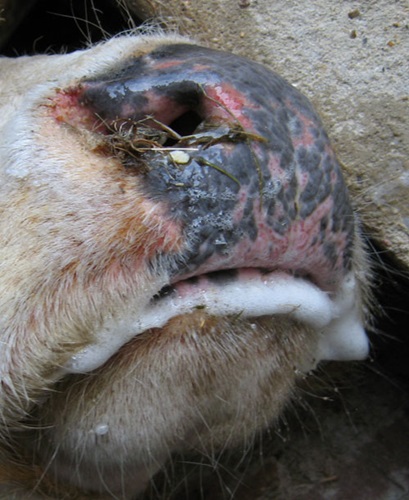
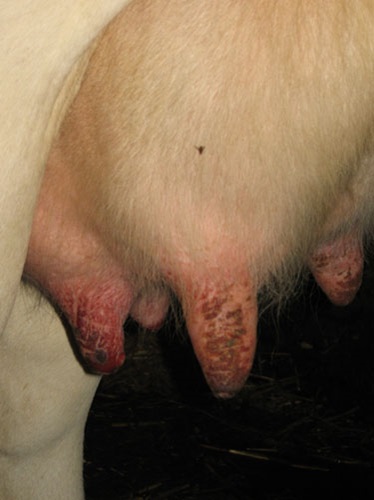
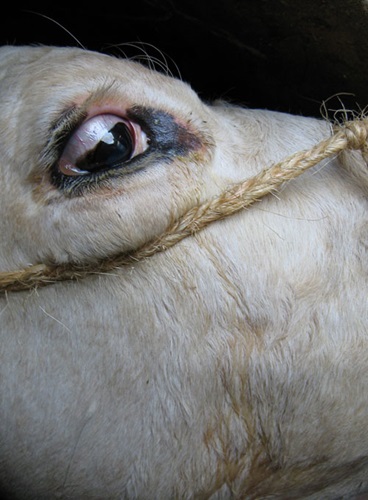
Bijlage: Foto's schaap