Het PCV-2 komt wijd verbreid voor. Het virus kan een rol spelen bij diverse ziektebeelden. Ziekten, waarin PCV2 een rol speelt, worden aangeduid met PCVD (Porcine Circo Virus Diseases). De bekendste ziekte is PMWS. Daarnaast kan PCV2 een rol spelen bij luchtweg-, darm-, circulatie- en vruchtbaarheidaandoeningen en mogelijk bij aandoeningen van het CZS.
Direct naar:
Het PCV2 grijpt aan op meerdere orgaansystemen in het lichaam, zonder dat dat direct gepaard gaat met het optreden van PMWS.
- Luchtwegaandoeningen: het PCV2 kan de oorzaak zijn van niezen bij jonge varkens en kan de vorming van een longontsteking verergeren. Hierbij zij opgemerkt dat ook in "gezond" longweefsel een hoge PCV2 virusload gevonden kan worden.
- Darmaandoeningen: Het PCV2 kan een rondkernige/proliferatieve darmontsteking veroorzaken, al dan niet gepaard gaande met cryptenabcesjes. Het klinisch en pathologisch beeld kan sterk lijken op een Lawsonia infectie.
- Fertiliteitaandoeningen: Het PCV2 kan een op PPV (Parvo) gelijkend ziektebeeld geven, die gepaard gaat met terugkomen en mummificatie van foeten. PCV2 geeft voor zover bekend geen abortus. Het foetale hart is gevoelig voor PCV2. Een myocarditis in combinatie met een hoge virusload PCV2) is indicatief voor de diagnose. Aangezien lekkage van PCV2 antilichamen van zeug naar foet via placenta mogelijk is, is serologisch onderzoek van foeten op PCV2 afweerstoffen niet zinvol.
Viruseigenschappen
Er worden drie hoofdtypen beschreven van het PCV2, namelijk a (aanwezig voor de "grote" PCV2 uitbraken, b (in koppels met PMWS, vanaf 2004) en c (alleen aangetoond in Denemarken). Hoewel de homologie tussen de hoofdtypen hoog is (>90%) bestaan er aanzienlijke verschillen zowel tussen als binnen de typen (monoclonaal gebied). Het virus verandert nog steeds, zodoende zijn in de toekomst meerdere typen te verwachten. Het virus heeft sterke affiniteit tot snelgroeiende cellen (blastocysten, macrofagen). De pathogenese van een PCV2-infectie is nog grotendeels onbekend.
Transmissie
Het PCV2 wordt uitgescheiden via alle lichaamsopeningen inclusief sperma. Na besmetting kan het virus in sperma 5-47 dagen worden aangetoond. Het is niet bekend hoeveel virus nodig is om foeten te kunnen besmetten. Daarnaast is het niet duidelijk in hoeverre transplacentaire spreiding kan optreden. Dit is mogelijk afhankelijk van de virusload. Embryo’s vanaf een leeftijd van 7 dagen zijn gevoelig voor PCV2. PCV2 spreidt niet of nauwelijks in de uterus.
Het PCV2-virus bevat geen enveloppe. En is zeer resistent. De spreiding binnen hokken verloopt snel (geschatte R0 waarde 5,5-8,9) de spreiding tussen hokken verloopt langzamer (geschatte R0 0,58-1,2): (Andraud, Ploufragan). Transmissie van het virus gebeurt vooral via aankoop van besmette varkens en via mest. PCV2 is gevoelig voor o.a. het desinfectiemiddel Virkon-S® (Dupont).
PMWS bij varkens, officieel Postweaning Multisystemic Wasting Syndrome, wordt vaak aangeduid als 'wegkwijnziekte'. De ziekte werd in 1991 bij (gespeende) biggen en (jonge) vleesvarkens in West-Canada opgemerkt. In 1996 werd voor het eerst een verband beschreven tussen PMWS en PCV2. Pas in 1998 werd in ons land voor het eerst de aanwezigheid van het PCV2-virus bevestigd.
Op veel bedrijven waar dieren lijden aan PMWS komt in het vervolg van het ziekteverloop Porcine Dermatitis Nefritis Syndroom (PDNS) voor. Deze ziekte is geassocieerd met een excessieve reactie van het immuun systeem bij persistentie van het PCV2 (type 2-overgevoeligheid).
Pathogenese PMWS
De pathogenese van PMWS is nog steeds niet opgehelderd. Vast staat dat het PCV2 alleen geen klinische verschijnselen opwekt. Naast het PCV2 zijn andere factoren van belang. Het is nog steeds niet duidelijk of alle factoren in kaart zijn gebracht.
De belangrijkste risicofactoren zijn (Segales 2013).
(a) aanwezigheid van PCV2-b
(b) vroege infecties bij biggen (in relatie tot gebrek aan biestopname en overleggen en mengen van groepen biggen).
(c) co-infecties (PRRSv, PPV, Mycoplasma hyopneumoniae).
Andere belangrijke factoren zijn: andere ziektekiemen, als het PRRS-virus, influenzavirus, parvovirus, bacteriële infecties zoals Haemophilus parasuis, Streptococcus suis, App, P. multocida, B. bronchiseptica, Mycoplasma species, etc. Ook niet infectieuze agentia als adjuvantia van entstoffen en andere (zie onder preventie) kunnen eveneens een rol spelen. Ook erfelijke factoren spelen een rol. Meestal worden de ziekteverschijnselen opgemerkt bij een beperkt percentage van de biggen in de geïnfecteerde koppel (variërend van 0 tot 50 procent). Op probleembedrijven kan het percentage door PMWS en PDNS aangetaste biggen gunstig worden beïnvloed door het gebruik van specifieke beren op zeugen van die bepaalde kruisingen.
Klinische verschijnselen PMWS
De combinatie van onderstaande klinische verschijnselen wordt als specifiek voor PMWS beschouwd. Vooral de eerste zes symptomen worden vaak opgemerkt:
- vermageren (wasting), niet willen groeien
- vergrote lymfeklieren (in lies, darmscheil en bronchën)
- kortademigheid (dyspneu), soms met droge hoest, na inspanning
- diarree
- bleekheid (anemie)
- koorts
- niezen, met conjunctivitis
- geel worden (icterus)
- maagzweren
- hersensymptomen, soms ook nystagmus
- acute sterfte (myocarditis)
- locomotiestoornissen (stijfheid en artritis)
De ziekteverschijnselen worden vooral bij de gespeende biggen en jonge vleesvarkens waargenomen, in de leeftijd tussen zes en zestien weken. Deze variatie wordt wel toegeschreven aan het verloop van de afname van de maternale immuniteit en het al of niet (vroegtijdig) op gang komen van de besmetting met PCV2 en andere infecieuze agentia. Mogelijk wordt het immuunsysteem van de big door de virale belasting van PCV2 uitgeput, waardoor tegen bovengenoemde ziektekiemen (zie pathogenese) een relatieve weerstandvermindering optreedt.
Pathologie PMWS
Uit virologisch en histopathologisch onderzoek van de organen van varkens die lijden aan PMWS blijkt dat verschillende organen aangetast zijn, onder andere lever, nieren, longen en lymfeklieren. Hiermee valt een groot deel van de ziekteproblemen bij aangetaste dieren te verklaren.
Pathogenese PDNS
De betekenis van PCV2 in PDNS is nog steeds controversieel. PDNS wordt geassocieerd met een excessieve reactie van het immuunsysteem met afweerstoffen tegen onder andere PCV2. Dit resulteert in immuuncomplexafzetting in capillairen, vooral in de nieren en de huid.
Evenals bij PMWS hebben ook bij PDNS secundaire kiemen invloed op de mate van voorkomen. Hierbij worden genoemd parvovirus, Brachyspiren en Lawsonia.
Klinische verschijnselen PDNS
De huid van varkens met PDNS is bleek. Vooral op de achterhand en tussen de dijen vindt men haemorrhagiën overgaand in dermatitis en/of dermo-necrosehaarden of in elkaar vloeiende ‘velden’.
Ook vertonen dieren met PDNS frequent locomotiestoornissen; ze lopen stijf, met een gebogen rug; de pijnlijkheid bij bewegen neemt toe. De achterpoten zijn vaak iets opgezwollen. Omdat niet alle dieren dermatitis ontwikkelen, kan men gevallen van acute sterfte bij jonge dieren missen als zijnde ‘acute’ PDNS-gevallen.
Aangedane dieren kunnen ook aan de slachtlijn worden herkend. Afwijkingen aan nieren (sterk vergroot), lymfeklieren, longen en maagdarmstelsel zijn hier vaak zichtbaar.
Diagnostiek
De diagnose PMWS is pas gesteld bij
(1) aanwezigheid van bovengenoemde ziekteverschijnselen bij meerdere varkens uit een koppel,
(2) bevestigd door histo-pathologisch onderzoek (minimaal bij 3 van de 5 ingezonden varkens vertonen in lymfoïde weefsels histopathologische afwijkingen zoals beschreven voor PMWS) en
(3) de aanwezigheid van een voldoende hoge virusload in de organen.
De virusload die klinisch van betekenis is, is (als richtlijn):
(a) voor organen >100.000 DNA kopieën/μgr,
(b) voor serum en speeksel > 10.000 DNA kopieën/μgr.
Bij op het oog gezonde dieren in probleemkoppels kunnen ook duidelijke lymfekliervergrotingen worden vastgesteld. Bij wegkwijnende dieren daarentegen valt vaak op dat de lymfeklieren atrofisch (en depletisch) worden. Bij een deel van de ernstig aangetaste dieren zijn de lieslymfeklieren nauwelijks vergroot, terwijl bij sectie de bronchiale en/of mesenteriale lymfeklieren sterk vergroot zijn.
In de lymfeklieren kan onder meer de mate van schors-mergactiviteit respectievelijk depletie worden vastgesteld, evenals het voorkomen van de typische meerkernige reuscellen. Omdat PCV2 ook bij gezonde varkens kan worden aangetoond, is het aantonen van dit virus niet zonder meer een diagnostisch criterium voor PMWS en PDNS.
Onderzoek op de secundaire agentia, die mede verantwoordelijk kunnen zijn voor de aandoening, is bij sectie ook aan te vragen, zoals:
- bacteriologisch onderzoek: bij longontstekingen, gewrichtsontstekingen, hersenvliesontsteking en darmontsteking. Tevens wordt een gevoeligheidsspectrum van de geïsoleerde pathogene kiemen bepaald;
- onderzoek naar influenzavirussen en parvovirus.
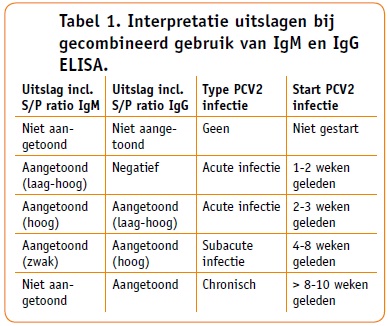
Bij bloedonderzoek kan gebruik gemaakt worden van de IgM- en IgG-ELISA of PCR. De PCV2 IgG/IgM ELISA kan gebruikt worden om vast te stellen of een PCV2 infectie zich in een acute, sub-acute of chronische fase bevindt. Dit kan geschieden op basis van een éénmalige bloedtap. Het gebruik van gepaarde sera is in dit geval niet meer nodig. In tabel 1 staan de interpretaties weergegeven bij het gebruik van beide ELISA's.
Na infectie kan het PCV2 meerdere weken in het bloed worden aangetoond, ook bij zeugen kan dit optreden.
Terug naar het begin van dit artikel
Behandeling van 'typische' PMWS of PDNS-biggen verloopt vaak teleurstellend. Aangedane dieren kunnen het best apart van de (grote) groep in een afgescheiden deel (hok) binnen de afdeling worden gehuisvest. De dieren kunnen het best worden gevoed met licht verteerbaar voedsel in brijvorm. Tegen secundaire bacteriële infecties kunnen antibiotica worden toegediend.
Vaccinatie: de varkenshouderij heeft de beschikking over uitstekende vaccins tegen PCV2. Deze vaccins beschermen de varkens voor een groot deel tegen de klinische verschijnselen van de ziekte. Een infectie wordt echter niet altijd voorkomen.
Naast vaccinatie tegen PCV2 dient de nodige aandacht te worden besteed aan verbetering van bedrijfsfactoren:
- De gelten en zeugen dienen een goede weerstand tegen de bedrijfseigen ziektekiemen te kunnen opbouwen. Een goede quarantaineadaptatiestal + beleid is een vereiste. Een quarantaine-adaptatieperiode dient minimaal 12 weken te zijn.
- Een goede biestproductie de eerste 24 uur na de geboorte van biggen is belangrijk. Bij de overgang van dracht- naar kraamstal zijn een goede voeroverschakeling, huisvesting, klimaatbeheersing en watergift belangrijke aandachtspunten.
- Voeding in de dracht en de genetica (rassenkeuze) verdienen aandacht om te zorgen voor vitale biggen met een voldoende geboortegewicht.
- Het is belangrijk dat de uiers van de zeugen goed melk kunnen produceren van de voorste tot en met de achterste spenen. Zeugen met slechte uiers kunnen het best worden vervangen; let daarbij vooral op de achterste spenen.
- Het overleggen van biggen dient te worden beperkt en alleen uitgevoerd te worden tot 24 uur na de geboorte.
- De ijzervoorziening van de biggen is van belang (ijzertoediening tussen 1-3 dagen na de geboorte).
- Coccidiose dient adequaat te worden bestreden.
- Een goed speengewicht is van belang.
- Een goede voer- en wateropname van de biggen voor en na het spenen is belangrijk.
- De klimaatbeheersing moet goed functioneren: de voelers dienen op de juiste plaats te hangen en ook goed te werken.
- Vaccineer gelten en zeugen schematisch en consequent.
- Vaccineer biggen tegen PRRS en/of M.hyo, uitsluitend onder begeleiding van diagnostiek, ter bepaling van het infectiemoment en het verloop in de koppels biggen. Vaccinatie op een onjuist tijdstip lijkt soms de problemen te verergeren.
- Pas eventueel de beerkeuze aan of neem een andere zeugenlijn.