Bron: Diergeneeskundig Memorandum Oncologie Gezelschapsdieren 2014
Auteur: Arno Roos (MSc. Clinical Oncology) met medewerking van Jurgen Tan
Symptomen van Mastocytoom
Meestal openbaart een goed gedifferentieerd mastocytoom zich als een langzaam groeiende, soms dunbehaarde tot kale massa in de huid. Mastocytomen kunnen overal op het lichaam ontstaan en ze worden ook wel de ‘great imitator’ genoemd omdat ze zich voor kunnen doen als iedere andere huidtumor. Zo voelt een deel van de mastocytomen aan als een lipoom en kan het onderscheid alleen gemaakt worden door het nemen en beoordelen van dunne naald (aspiratie) biopten. De tumor kan soms maanden aanwezig zijn zonder opvallende groei; soms geeft de eigenaar zelfs aan dat de bult wisselt in omvang. Berucht zijn ook de mastocytomen die lang aanwezig geweest zijn zonder noemenswaardige groei en dan plotseling snel groeien.
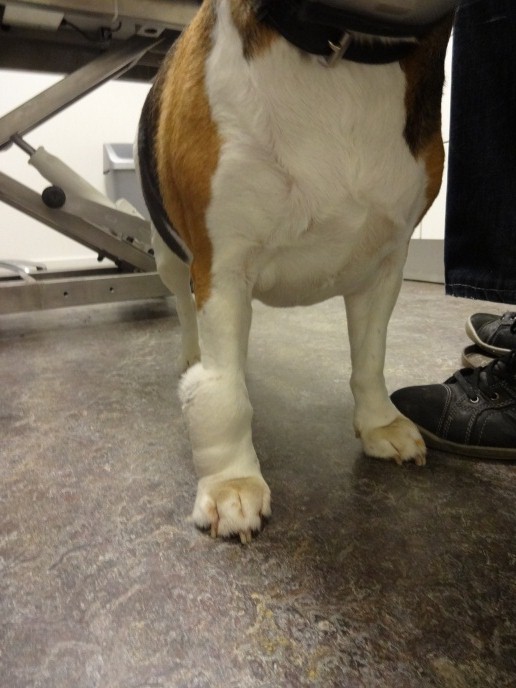
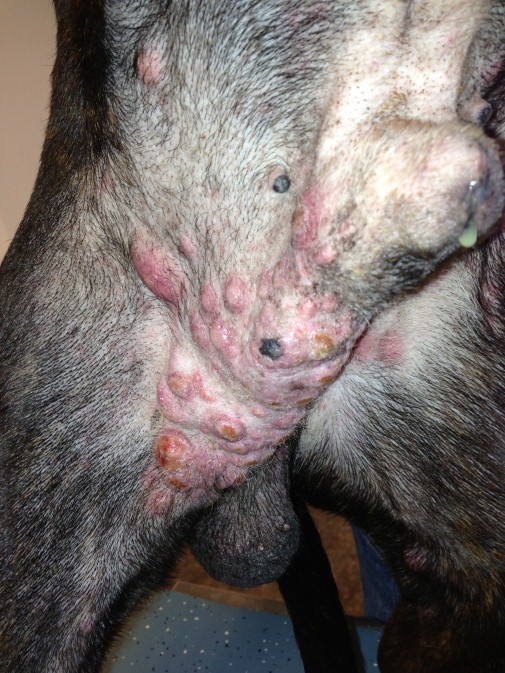
Afbeeldingen: Mastocytomen kunnen zich op vele manieren manifesteren en doen de bijnaam ‘the great pretender’ daarmee alle eer aan
Slecht gedifferentieerde mastocytomen groeien meestal snel, ulcereren vaak en geven irritatie. Soms zijn er kleine ‘satelliet laesies’ om de primaire tumor aanwezig. Deze mastocytomen zaaien vaak uit en daardoor kunnen vergrote regionale lymfeklieren en/of vergrote lever of milt voelbaar zijn bij het lichamelijk onderzoek.
Daarnaast heeft 10 tot 15 procent van de honden multipele primaire mastocytomen hetzij gelijktijdig, maar soms ook subsequent na verwijdering van eerdere mastocytomen. In tegenstelling tot wat vroeger gedacht werd, gaat men er op dit moment vanuit dat de prognose voor deze honden hetzelfde is als voor honden met één mastocytoom. Wel moet de eigenaar bereid gevonden worden de steeds opnieuw ontstane mastocytomen chirurgisch te laten verwijderen.
Behalve de lokale verschijnselen kunnen mastceltumoren ook systemische verschijnselen veroorzaken door het vrijkomen van de biologisch actieve stoffen die in de intracytoplasmatische granulae van de mastcellen zijn opgeslagen. Dit zijn stoffen zoals proteases, cytokines, heparine en histamine. Alleen al door het palperen van een mastocytoom kunnen mastcellen degranuleren en waardoor deze stoffen vrijkomen, hetgeen leidt tot erytheem en oedeemvorming. Dit verschijnsel staat bekend als het ‘Darier sign’. Door de optredende vasodilatatie valt bij het nemen van naaldbiopten van een mastocytoom vaak het nabloeden uit de punctieplaatsen op, terwijl dat bij andere tumoren bijna nooit gebeurt na het nemen van naaldbiopten. Systemische effecten van deze stoffen kunnen leiden tot paraneoplastische verschijnselen als braken en melena door het ontstaan van maag en darm ulcera. Door de daarbij optredende verminderde eetlust zal de hond ook afvallen. Zelden waargenomen systemische verschijnselen zijn hypotensieve collaps en ademhalingsproblemen.
Terug naar het begin van dit artikel
Diagnose van Mastocytoom
Het stellen van de diagnose mastocytoom is vaak eenvoudig. Net als andere rondceltumoren krijgen we bij het nemen van naaldbiopten meestal een goede opbrengst en cytologie geeft vaak een duidelijke diagnose door de aanwezigheid van de intracytoplasmatische granulae. Bij een slecht gedifferentieerd mastocytoom kunnen deze granula ontbreken en kunnen aanvullende kleuringen nodig zijn om de diagnose te stellen. Een cytologisch biopt geeft geen uitsluitsel over de graad van het mastocytoom, maar de mate van differentiatie kan wel een idee over de graad geven. In de figuur hieronder wordt aangegeven hoe het cytologisch beeld de verdere opwerking van een patiënt kan beïnvloeden.
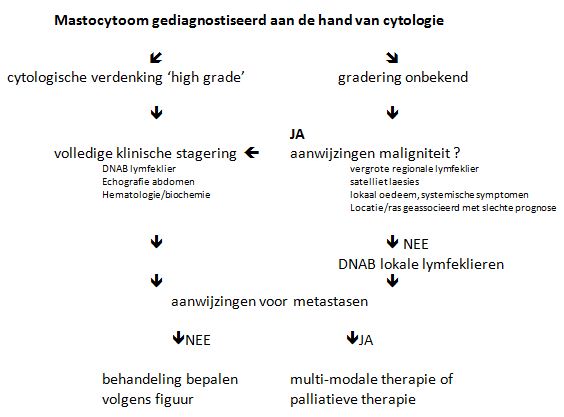
Figuur: opwerkschema mastocytoom aan de hand van een cytologische diagnose
Bij mastocytomen is het uitermate belangrijk om de patiënt goed te onderzoeken. Dit begint met een zorgvuldige palpatie van het gehele lichaam om de aanwezigheid van meerdere mastocytomen uit te sluiten, waarbij elk bultje dat gevonden wordt gepuncteerd moet worden. De meeste honden zullen tumoren hebben die niet zullen uitzaaien en niet iedere patiënt hoeft daarom voor het verwijderen van de tumor volledig gestageerd te worden. Maar als een uitgebreide chirurgie of dure behandeling overwogen wordt, wordt stageren wel aanbevolen. Het biopteren van de regionale lymfeklier wordt altijd geadviseerd, omdat regelmatig in niet vergrote lymfeklieren toch metastasen worden aangetoond.
Op dit moment is men van mening dat als er in de lymfeklier geen metastasen worden aangetoond de kans op verdere metastasering naar lever en/of milt zeer klein is. De beoordeling van de buffycoat als indicator van mastcel metastasering is onbetrouwbaar gebleken en dient niet meer te worden gebruikt.
Onderstaande figuur geeft het WHO stageringssysteem voor mastceltumoren bij de hond, maar ook dit systeem staat ter discussie. Zo zijn er studies die geen verschil aangeven tussen honden met een enkele of meerdere mastocytomen, terwijl andere studies gevonden hebben dat honden met multiple mastocytomen het wel slechter doen dan honden met één enkel mastocytoom. Zelfs is er controverse over het effect van positieve lymfeklieren op de prognose. Maar ondanks deze tekortkomingen heeft het stageringssysteem nog steeds zijn waarde bij het opwerken van de patiënt.
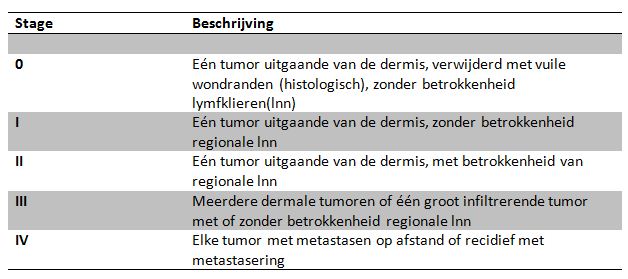
Tabel: WHO stageringssysteem voor canine mastceltumoren
Prognostische factoren die de behandeling beïnvloeden
De behandeling van mastocytomen is een uitdaging voor de dierenarts. Het grote verschil in biologisch gedrag bij de diverse patiënten maakt deze tumor bij uitstek een tumor die een individuele behandeling behoeft. De histologische graad van een mastocytoom is de meest belangrijkste prognostische factor
De gradering van mastocytomen gebeurt aan de hand van celmorfologie en de invasiviteit van de tumor in de omgeving. Het graderingsysteem volgens Patnaik is het langst gebruikt en deelt mastocytomen in drie graden in. Het blijkt echter er dat met name bij graad 2 mastocytomen veel variatie tussen de beoordeling verschillende pathologen bestaat. Dit heeft ertoe geleid dat Kiupel in 2011 een voorstel heeft gedaan voor een nieuw graderingsysteem met slechts twee graderingen. Op dit moment worden beide systemen vaak naast elkaar gebruikt en wordt van één tumor zowel de Patnaik als de Kiupel gradering gegeven. Onderstaande figuur geeft de criteria van het Patnaik graderingsysteem. Bij het Kiupel graderingsysteem wordt alleen onderscheid gemaakt tussen ‘low grade’ en ‘high grade’ mastocytomen. Een mastocytoom wordt ‘high grade’ genoemd als hij voldoet aan één van de volgende criteria: minimaal zeven mitosefiguren in 10 high power fields (hpf); minimaal drie multinucleaire (drie of meer kernen) cellen in 10 hpf; minimaal drie bizarre nuclei (sterk atypisch met duidelijke indentatie, segmentatie en onregelmatige vorm) per 10hpf en karyomegaly (de diameter van de nuclei van minimaal 10 procent van de neoplastische cellen varieert minimaal een factor 2). Deze eigenschappen dienen te worden beoordeeld in een gebied van het preparaat met de meeste mitotische activiteit of de hoogste mate van anisokaryosis.
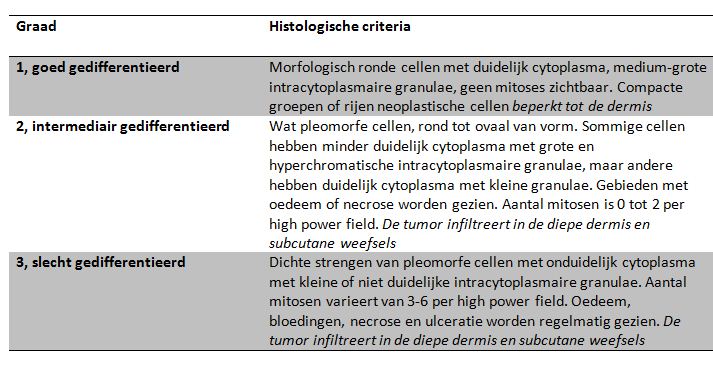
Tabel: Histologische criteria volgens Patnaik voor het graderen van mastocytomen
Goed gedifferentieerde mastocytomen (graad 1) hebben na chirurgie (zonder verdere aanvullende nabehandeling) een goede prognose, daar metastasering zelden optreedt. Intermediaire tumoren (graad 2) hebben nog steeds een redelijk goede prognose met 80 procent van de honden twee jaar na operatie nog steeds in leven, maar rond de 20 procent van deze patiëntengroep zal wel metastasen ontwikkelen. Slecht gedifferentieerde mastocytomen hebben een slechte prognose daar meer dan 80 procent van deze tumoren zal metastaseren.
Naast de graad van een mastocytoom zijn er een aantal kenmerken welke het te verwachten biologisch gedrag voorspellen:
- Honden die worden aangeboden met mastocytomen, die al langere tijd aanwezig zijn zonder in omvang te veranderen, doen het in het algemeen goed.
- Snel groeiende mastocytomen hebben meestal een slechte prognose.
- De aanwezigheid van paraneoplastische verschijnselen zoals anorexie, braken of melena geeft meestal een slechtere prognose.
- De aanwezigheid van satelietlaesies om de tumor is een ongunstig teken.
- Vergrote regionale lymfeklieren en een vergrote lever/milt bij lichamelijk onderzoek zijn ongunstige tekenen.
- Recidief van mastocytomen na chirurgie gaat gepaard met een ongunstige prognose.
- c-Kit expressie is gedereguleerd in 15 tot 40 procent van de mastceltumoren, meestal ten gevolge van mutaties in het c-Kit gen. Deze mutatie is geassocieerd met een slechtere prognose.
- Proliferatiemarkers zoals Ki67, AgNor en PCNA worden wel gebruikt, maar de mitose-index lijkt de goedkoopste maar meest zinvolle bepaling.
- Locatie is belangrijk: peri-anale, preputiale, inguinale en mucocutane mastocytomen lijken een minder gunstige prognose te hebben.
- Ras is belangrijk: Boxers en Mopshondjes hebben meestal minder agressieve mastocytomen en Sharp-peis meestal zeer agressieve mastocytomen.
Terug naar het begin van dit artikel
Behandeling van Mastocytoom
De behandeling van mastocytomen hangt af van de klinische verschijnselen, de stage en de histologische graad. De belangrijkste vragen voor de practicus om te beantwoorden zijn:
- Is chirurgische excisie mogelijk?
- Is alleen lokale excisie voldoende of moet er ook een systemische behandeling worden ingesteld?
Chirurgie
Chirurgie is de voorkeursbehandeling voor gelocaliseerde, niet-gemetastaseerde mastceltumoren. Omdat mastcellen door de chirurgische manipulatie kunnen degranuleren is het aan te raden om al pre-operatief te beginnen met het geven van H1- en H2-blokkers en hier minimaal vijf dagen na de operatie mee door te gaan. Daarnaast verdient het aanbeveling om de hechtingen minimaal veertien dagen te laten zitten, daar door de histamine release de wondgenezing na operatie vertraagd kan zijn.
Bij het chirurgisch verwijderen van een mastocytoom is het verkrijgen van adequate marges van zeer groot belang. Geadviseerd wordt om een marge van minimaal 2 centimeter te nemen in ALLE dimensies; voor de diepe marge geldt dat minimaal één fascielaag moet worden meegenomen. Het blijkt dat vooral de diepe marge vaak niet voldoende groot wordt genomen. Als de tumor groot is of op een moeilijke locatie zit (bijvoorbeeld op een extremiteit), kan het maken van een huidflap nodig zijn om het defect te sluiten. Zeker bij dergelijke grote operaties moet men zich bedenken of men de operatie zelf kan uitvoeren of dat het beter is deze patiënt door te sturen naar een oncologisch chirurg. Het ‘down-graden’ oftewel kleiner maken van de tumor door het geven van corticosteroïden, zodat men de tumor makkelijker kan verwijderen, moet worden ontraden omdat mogelijk de tumor wel kleiner oogt, maar de microscopische uitlopers van de tumor niet meegeslonken zijn en men op deze manier de kans op onvolledige verwijdering van de tumor groter maakt (zie onderstaande figuur).
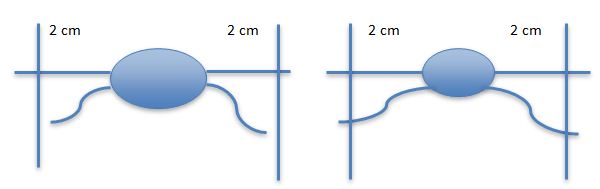
Als ruime chirurgische verwijdering niet mogelijk is, kan men beslissen tot een marginale verwijdering van het mastocytoom gevolgd door adjuvant radiotherapie. Als radiotherapie niet mogelijk is, kan ook chemotherapie gekozen worden als adjuvante therapie. Ook kan in dit geval besloten worden niet te opereren en de tyrosine kinase inhibitors (Palladia, Masivet)in te zetten.
Na chirurgische verwijdering van een mastocytoom moet dit altijd worden ingestuurd voor histopathologisch onderzoek. Ook bij honden waarbij in de loop van de tijd al eerder mastceltumoren verwijderd zijn, welke steeds laaggradig bleken te zijn, is dit onderzoek onontbeerlijk, daar het nieuwe mastocytoom wel degelijk hooggradig kan zijn. Het beoordelen van de chirurgische marges is zeer belangrijk. De verwijderde tumor kan beoordeeld worden als:
- Volledig verwijderd (geen tumorcellen gezien binnen 1 mm van de chirurgische marge)
- Volledig, maar krap verwijderd (mastcellen gezien binnen 1 mm van de chirurgische marge)
- Onvolledig verwijderd (mastcellen tot aan de chirurgische marge)
Als er strengen of clusters van mastcellen tot aan de chirurgische marge lopen, is de tumor onvolledig verwijderd. Echter, als er slechts enkele mastcellen aan de periferie van het monster gezien worden, is het moeilijk om uit te maken of het om tumorcellen gaat of om fysiologische mastcellen, welke door chemotaxis naar het gebied getrokken zijn. Ook blijkt een deel van de ogenschijnlijk onvolledig verwijderde graad II tumoren nooit te recidiveren en treedt er in 5 tot 20 procent van de volledig verwijderde tumoren wel lokaal recidief op. Vast staat dat de kans op recidief bij niet-schone marges significant hoger is dan bij schone chirurgische marges.
Het behandelplan wordt sterk bepaald door de histopathologische beoordeling van de chirurgische marges:
- Graad I en II tumoren met histologisch volledige verwijdering: Geen aanvullende lokale behandeling noodzakelijk, maar klinische controles worden wel geadviseerd. Bij aangetoonde metastasen is daar een adjuvante behandeling voor noodzakelijk.
- Graad I en II tumoren met macroscopisch volledige verwijdering maar histologisch onvolledige verwijdering: De voorkeursbehandeling in deze situatie is heroperatie met een ‘en bloc’ resectie van het operatielitteken met 2 centimeter marge. Radiotherapie is een alternatief en daar een deel van deze tumoren niet zal recidiveren, kan besloten worden tot een exspectatieve houding met regelmatige klinische controles. Wel dient men bij deze derde optie de eigenaren op de risico’s van deze keuze te wijzen. Zodra er sprake is van macroscopisch zichtbare restanten van de tumor, recidief van de tumor of het optreden van metastasen, valt deze derde keuze af.
- Graad I en II tumoren met betrokkenheid van de lymfeklieren, maar geen metastasen op afstand: Chirurgie inclusief het verwijderen van de aangetaste lymfeklier gevolgd door radiotherapie is de behandeling van voorkeur. Deze behandeling leidt tot een mediane ziekte-vrije periode van 40 maanden! In verband met de kans op het ontwikkelen van metastasen op afstand moet ook het geven van chemotherapie aan deze patiënten overwogen worden.
Radiotherapie
Chirurgie is de beste behandelmethode voor lokale behandeling van mastceltumoren. Het bestralen van grote mastceltumoren geeft een risico op ernstige systemische verschijnselen als gevolg van bestraling-geïnduceerde degranulatie van mastcellen. Daarnaast zullen grote tumoren ook radioresistente tumorcelclonen bevatten ten gevolge van de aanwezigheid van hypoxische gebieden in de tumor.
Radiotherapie wordt het meest gebruik als een post-operatieve adjuvant therapie na onvolledige verwijdering van een mastocytoom. Met de plaatsing van de lineaire versneller bij de Faculteit Diergeneeskunde van de Universiteit Utrecht en het orthovoltage bestralingsapparaat bij het Kankercentrum voor Dieren te Gouda zijn er in Nederland op dit moment twee locaties waar deze behandeling uitgevoerd kan worden.
Vanaf enkele dagen voor het starten van de bestralingsbehandeling tot vier weken na het eind van het bestralingsprotocol worden vaak corticosteroïden gegeven om de ernst van de bestralings-geïnduceerde degranulatie te reduceren. Ook het geven van H1- blokkers zoals tavegil en H-2 blokkers zoals cimetidine of ranitidine is om dezelfde reden te adviseren.
Chemotherapie
Chemotherapie kan pre-operatief (neo-adjunvant) worden ingezet om een moeilijk te verwijderen tumor in omvang te doen afnemen. Maar zoals eerder genoemd moet men met het down-graden van mastocytomen er aan denken dat men mogelijk ook valse ruime marges creëert. Er zijn op dit moment geen goede studies die een dergelijk gebruik van chemotherapie ondersteunen.
Chemotherapie dient vooral ingezet te worden bij mastocytomen met een groot risico op metastasering: graad III tumoren, tumoren die door de patholoog als graad II/III beoordeeld worden en graad II tumoren met aanwezige metastasen of risicofactoren als een hoge mitose index of hoge proliferatiemarkers. Daarnaast kan chemotherapie ook worden ingezet voor de behandeling van residuaal tumorweefsel na (microscopisch) onvolledige verwijdering van de primaire tumor en er geen radiotherapie beschikbaar is.
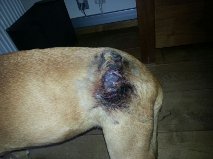
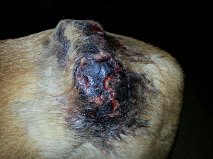
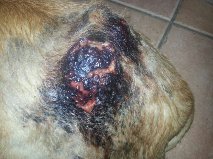
Figuur: Recidief van een onvolledig verwijderd hooggradig mastocytoom (linksboven). Door de chemotherapeutische behandeling treedt een uitgebreide reactie met veel necrosevorming op (rechtsboven, linksonder en rechtsonder). Uiteindelijk is deze hele tumor ‘eraf gevallen’, maar de hond ontwikkelde uitgebreide metastasering in de inwendige lymfeklieren, milt en lever.
Voor de chemotherapeutische behandeling van mastocytomen bestaan verschillende opties:
- Monotherapie met vinblastine + prednison. Er bestaan verschillende protocollen met een monotherapie met vinblastine. Deze variëren van acht tot twaalf keer en van wekelijks tot tweewekelijks. Daarnaast wordt er in de laatste jaren vaker gebruik gemaakt van een ‘dose escalating’ protocol, waarbij gestart wordt met de standaard dosering van 2mg/m2 en deze aan de hand van het bloedbeeld ten tijde van de nadir indien mogelijk steeds wordt verhoogd met 0,5 mg/m2. Het blijkt dat de maximaal getolereerde dosering bij honden sterk varieert. Sommige honden ontwikkelen al bij de startdosering van 2mg/m2 een leucopenie, terwijl andere honden tot 6mg/m2 verdragen.
- Monotherapie met lomustine (CCNU®) + prednison. Hierbij wordt CCNU® 1x per 3 weken toegediend. Het voordeel van dit protocol is dat de CCNU® per os gegeven kan worden en dus geen infusen nodig zijn.
- Combinatietherapie van vinblastine en lomustine + prednison. Er bestaan inmiddels vele combinaties van vinblastine en lomustine, variërend in de intervallen tussen de middelen en de gebruikte dosering van beide middelen.
- Met het opkomen van de tyrosine kinase inhibitors (TKI’s)zijn er ook protocollen ontwikkeld waarbij gebruik gemaakt wordt van zowel chemotherapeutica als deze tyrosine kinase inhibitors. Bij sommige protocollen worden de TKI’s volgens het normale schema gegeven en alleen onderbroken enkele dagen rond het toedienen van het chemotherapeuticum, maar er zijn ook protocollen waarbij de TKI’s juist als ‘chemosensitiser’ gegeven worden rondom het moment van chemotherapeutische behandeling.
Tyrosine kinase inhibitors (TKI’s)
Receptor tyrosine kinases (RTK’s) zijn een belangrijke groep van receptoren op de celmembraan, die de proliferatie, differentiatie en overleving van de cel stimuleren. Dysfunctie van één van deze RTK’s, het c-KIT, speelt bij mastocytomen een grote rol. Bij ongeveer 30 procent van de hooggradige mastocytomen (graad II/III) wordt een zogenaamde gain-of-function mutatie in het c-KIT gen aangetroffen. Dit zorgt voor een constante activatie van de KIT-receptor en daarmee het optreden van toegenomen proliferatie, migratie en differentiatie. Specifieke ‘small-molecule’ tyrosine kinase inhibitoren (TKI’s) remmen de activiteit van de RTK’s.
Op dit moment zijn er twee TKI’s toegelaten voor het gebruik bij honden met mastocytomen, maar met een zeer specifieke registratie:
- Tocaranib fosfaat (Palladia). Dit is geregistreerd voor de behandeling van recidiverende, niet te verwijderen graad II/III mastocytomen
- Masitinib (Masivet). Dit is geregistreerd voor de behandeling van niet te verwijderen graad II/III mastocytomen met een aangetoonde cKIT mutatie
Het voordeel van deze middelen is het feit dat men ze per os kan toedienen en er dus geen infusen nodig zijn. Een ander voordeel is dat het geen cytostatica zijn, maar dit houdt zeker niet in dat er geen bijwerkingen op kunnen treden bij het gebruik van deze middelen. Ook deze middelen kunnen zeer ernstige, zelfs fatale bijwerkingen hebben en patiënten, die deze middelen krijgen, moeten minimaal net zo goed gecontroleerd worden als patiënten, die cytostatica krijgen. Een ander nadeel van deze middelen is de zeer nauw omschreven registratie. Inmiddels is er de afgelopen jaren steeds meer ervaring verkregen met het gebruik van deze middelen, ook in gevallen buiten de geregistreerde indicaties. Echter, men moet zich er bewust van zijn dat dit valt onder het ‘off-label’ use van het middel.
Met de TKI’s zijn de vier belangrijkste behandelmethoden voor de behandeling van mastocytomen behandeld. Echter, in de literatuur komen nog vele andere behandelingen voor. Hierbij kan men denken aan het intra-laesionair spuiten van corticosteroïden, immunotherapie, hyperthermie, fotodynamische therapie en cryochirurgie. Eén behandelmethode verdient wel wat meer aandacht omdat deze in de loop van de tijd steeds opnieuw naar voren komt. Het gaat om het inspuiten van ge-demineraliseerd water in het operatiegebied in de gevallen waarvan men weet dat de verwijdering marginaal of mogelijk incompleet zal zijn. Sommige studies geven een dat dit de kans op lokaal recidief zou verkleinen, terwijl andere studies dit tegenspreken. Gezien de sterk wisselende resultaten is dit een behandeloptie die hier niet geadviseerd kan worden.
In onderstaande figuren is geprobeerd om rekening houdend met alle verschillende behandelopties een stroomdiagram te maken om tot de juiste behandeling van de individuele hond met een mastocytoom te komen.
Prognose
Zoals eerder genoemd wordt de prognose van honden met een mastceltumor vooral bepaald door de graad van het mastocytoom. Meer dan 90 procent van de dieren met een graad I mastocytoom zal na een adequate chirurgie een zeer lange overlevingsduur hebben (meer dan twee jaar). Ook ongeveer driekwart van de honden met een graad II tumor zal een dergelijk lange overlevingsduur kennen en in slechts een kwart van de graad II tumoren zullen metastasen ontstaan, welke de overlevingsduur verkorten. Bij graad III tumoren zullen in het overgrote deel van de gevallen (60 tot 85 procent) ten tijde van de diagnose al metastasen aanwezig zijn of zullen deze zich op enig moment na de diagnose ontwikkelen. De meeste van deze dieren zullen binnen één jaar aan de gevolgen van de tumor overlijden. Echter, met een multimodale therapie van chirurgie, radiotherapie en chemotherapie en zeker met de nieuwe beschikbare middelen zoals Palladia en Masivet kunnen we ook deze groep patiënten een zinvolle behandeling geven. Vaak is het mogelijk om ze nog gedurende een aanzienlijke periode een kwalitatief goed leven te geven en is behandeling voor dier en eigenaar zeker de moeite waard.

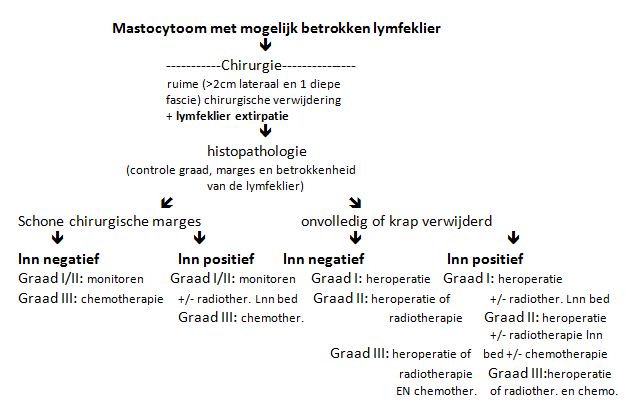
Figuur: Stroomdiagram voor de behandeling van de hond met een mastocytoom
Terug naar het begin van dit artikel